Hvad er entalpienændringen til konvertering af 1 mol is ved -50 grader Celsius til vand 70 Celsius?
1. Opvarmning af isen fra -50 ° C til 0 ° C:
* Specifik varmekapacitet af is (C_ICE): 2,09 J/g ° C.
* Mass af is (m): 1 mol * 18,015 g/mol =18,015 g
* temperaturændring (ΔT): 0 ° C - (-50 ° C) =50 ° C
* optaget varme (Q1): Q1 =M * C_ICE * ΔT =18,015 G * 2,09 J/G ° C * 50 ° C =1884,3 J
2. Smelter isen ved 0 ° C:
* entalpi af fusion (ΔH_fus): 6,01 kJ/mol =6010 J/mol
* optaget varme (Q2): Q2 =ΔH_FUS =6010 J
3. Opvarmning af vandet fra 0 ° C til 70 ° C:
* Specifik varmekapacitet af vand (C_Water): 4.18 J/g ° C.
* Mass af vand (M): 18.015 g
* temperaturændring (ΔT): 70 ° C - 0 ° C =70 ° C
* optaget varme (Q3): Q3 =M * C_WATER * ΔT =18,015 G * 4,18 J/G ° C * 70 ° C =5233,7 J
Total entalpiændring (ΔH):
ΔH =Q1 + Q2 + Q3 =1884.3 J + 6010 J + 5233.7 J = 13128 J eller 13.13 kj
Derfor er entalpienændringen til omdannelse af 1 mol is ved -50 ° C til vand ved 70 ° C ca. 13,13 kJ.
 Varme artikler
Varme artikler
-
 Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u
Carbon black genanvendes fra bildækTop, primærprodukt fra venstre til højre:rå rCB, ren rCB (96+), ren rCB med perler (96+). Bund, sekundære produkter genvundet fra asken, fra venstre til højre:flydende natriumsilicat eller vandglas, u -
 Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet
Brændstof fra udtjente dækKredit:CC0 Public Domain Brugte dæk udgør en alvorlig miljørisiko på grund af de skader, der kan opstå, når de opbevares i miljøet. De dukker op i stadig større antal fra det ene år til det andet -
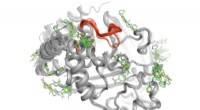 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak -
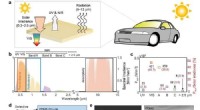 Synligt gennemsigtig strålingskøler under direkte sollysKredit:Pohang University of Science &Technology (POSTECH) Siden klimaaftalen fra Paris trådte i kraft i 2016, 121 lande har lovet at blive CO2-neutral i 2050, da verden forsøger at reducere sit br
Synligt gennemsigtig strålingskøler under direkte sollysKredit:Pohang University of Science &Technology (POSTECH) Siden klimaaftalen fra Paris trådte i kraft i 2016, 121 lande har lovet at blive CO2-neutral i 2050, da verden forsøger at reducere sit br
- Hvad er 6 -divisionen af fysik?
- Navngiv tre enheder eller opfindelser, der er designet til at reducere friktion?
- Hvad er pH for vandig ammoniak i forhold til pund pr. Gallon vand?
- Tilpasning til mørke:Hvordan adfærdsmæssige og genetiske ændringer hjalp hulefisk med at overlev…
- Deep learning og holografi skaber en bedre point-of-care sensor
- Sådan konverteres mol til molekyler


