De hydrochlorflasker, der er udeladt i laboratoriets tid, bliver dækket med hvidt pulver, antyder en mulig sammensætning til dette, hvorfor gør ammoniakbacome mindre end HCL?
Det hvide pulver
Det hvide pulver, der dannes på saltsyre (HCI) flasker, der er åben, er ammoniumchlorid (NH₄CL) . Her er hvorfor:
* HCL som gas: Hydrochlorsyre er en opløsning af hydrogenchlorid (HCI) gas opløst i vand. Når flasken er åben, slipper HCL -gas ud.
* luft og ammoniak: Luften indeholder små mængder ammoniakgas (NH₃).
* reaktion: HCL -gas reagerer med ammoniakgas i luften for at danne ammoniumchlorid, et hvidt fast stof.
Den kemiske ligning
Reaktionen kan repræsenteres ved denne ligning:
`` `
HCL (G) + NH₃ (G) → NH₄CL (S)
`` `
Hvorfor ammoniak bliver mindre end HCL
Udsagnet om, at ammoniak bliver "mindre end HCL", er lidt vildledende. Det er mere nøjagtigt at sige, at koncentrationen af ammoniak i luften normalt er lavere end koncentrationen af HCL, der slipper ud af flasken .
Her er hvorfor dette sker:
* Kilde til HCL: HCL kommer fra en koncentreret kilde (flasken), mens ammoniak kun er til stede i spormængder i luften.
* Volatilitet: HCL er en mere flygtig gas end ammoniak. Dette betyder, at det slipper lettere fra flasken.
* reaktion: Reaktionen mellem HCI og ammoniak fjerner ammoniak fra luften. Dette reducerer yderligere mængden af ammoniak, der er til rådighed for at reagere.
Sammenfattende er det ikke, at ammoniak bliver "mindre" i en eller anden absolut forstand; Det er, at koncentrationen af ammoniak i luften normalt er lavere end koncentrationen af HCI, der slipper ud af flasken, hvilket fører til et tilsyneladende "underskud" af ammoniak i reaktionen.
Sidste artikelHvad er den molekylære form af H2NConh2?
Næste artikelHvad er den molekylære formel af pepton?
 Varme artikler
Varme artikler
-
 Nyt bormateriale med høj hårdhed skabt af plasmakemisk dampaflejringYogesh Vohra. Kredit:UAB Yogesh Vohra, Ph.D., bruger mikrobølge-plasma kemisk dampaflejring til at skabe tynde krystalfilm af aldrig før sete materialer. Denne indsats søger materialer, der nærmer
Nyt bormateriale med høj hårdhed skabt af plasmakemisk dampaflejringYogesh Vohra. Kredit:UAB Yogesh Vohra, Ph.D., bruger mikrobølge-plasma kemisk dampaflejring til at skabe tynde krystalfilm af aldrig før sete materialer. Denne indsats søger materialer, der nærmer -
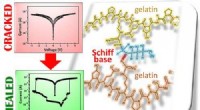 Selvreparerende gelatinebaseret film kan være et smart træk for elektronikKredit:American Chemical Society At tabe en mobiltelefon kan nogle gange forårsage overfladiske revner. Men andre gange, enheden kan helt stoppe med at fungere, fordi der udvikles brud i det mater
Selvreparerende gelatinebaseret film kan være et smart træk for elektronikKredit:American Chemical Society At tabe en mobiltelefon kan nogle gange forårsage overfladiske revner. Men andre gange, enheden kan helt stoppe med at fungere, fordi der udvikles brud i det mater -
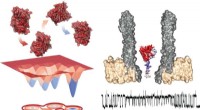 Nanopore afslører formskiftende enzym forbundet med katalyseEnergidiagram over de fire konformere (til venstre) og den eksperimentelle opsætning, der viser nanoporen med det fangede enzym i tværsnit (højre). Under, der er et typisk spor, der viser målinger und
Nanopore afslører formskiftende enzym forbundet med katalyseEnergidiagram over de fire konformere (til venstre) og den eksperimentelle opsætning, der viser nanoporen med det fangede enzym i tværsnit (højre). Under, der er et typisk spor, der viser målinger und -
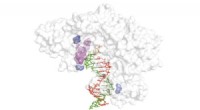 En ny rettet evolutionsteknik til at frigøre potentialet for xeno-nukleinsyrerDiagram, der viser den omvendte transkriptasestruktur (hvid) med spirende cDNA -streng (rød), XNA -skabelon (grøn) og områder kritiske for omvendt transkription af XNA -skabeloner (blå og lilla). Kred
En ny rettet evolutionsteknik til at frigøre potentialet for xeno-nukleinsyrerDiagram, der viser den omvendte transkriptasestruktur (hvid) med spirende cDNA -streng (rød), XNA -skabelon (grøn) og områder kritiske for omvendt transkription af XNA -skabeloner (blå og lilla). Kred
- Hvordan kan energi gå tabt i en kraftværksturbin?
- Sådan bygger du en klimabestandig vandforsyning
- Hvilket videnskabeligt princip siger, at energi kan overføres, men det kan ikke skabes eller ødelæ…
- Hvor kom den potentielle energi i gummibåndet fra?
- Hvornår bliver et blad ikke -levende ting?
- Grammarlys seneste værktøj fortæller dig, om din tekst kommer for hårdt ud


