Hvilke kovalente bindinger er det mest polære brint og fluor eller nitrogen?
* Elektronegativitet: Fluor er det mest elektronegative element på den periodiske tabel, hvilket betyder, at det har en stærk attraktion for elektroner. Kvælstof er også elektronegativ, men mindre end fluor.
* Polaritet: Jo større forskellen i elektronegativitet mellem to atomer, jo mere polær er bindingen. Elektronegativitetsforskellen mellem brint og fluor er signifikant større end forskellen mellem brint og nitrogen. Dette betyder, at elektronerne i H-F-bindingen trækkes meget stærkere mod fluor, hvilket skaber en meget større delvis negativ ladning på fluoratomet og en delvis positiv ladning på brintatomet.
Kortfattet: H-F-bindingen er den mest polære, fordi fluorens stærke elektronegativitet trækker de delte elektroner væk fra brintatomet, hvilket skaber en mere markant adskillelse af ladning.
 Varme artikler
Varme artikler
-
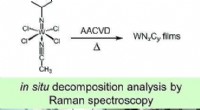 Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa
Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa -
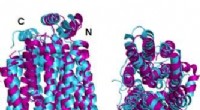 Ny forskning transformerer glukosetransportproteiner til vandopløselig formTo vinkler af den krystallinske struktur GLUT1 (magenta) glucosetransporterprotein overlejret med den AlphaFold2 computerforudsagte vandopløselige variant af det samme protein (cyan) viser, at det kry
Ny forskning transformerer glukosetransportproteiner til vandopløselig formTo vinkler af den krystallinske struktur GLUT1 (magenta) glucosetransporterprotein overlejret med den AlphaFold2 computerforudsagte vandopløselige variant af det samme protein (cyan) viser, at det kry -
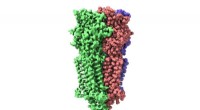 Cryo-EM afslører struktur og mekanisme for 5-HT3-receptorenGenerelt billede af 5-HT3-receptoren, som er lavet af 5 underenheder. Kredit:Hugues Nury, IBS/CNRS/ESRF I november 2017, et Titan Krios kryo-elektronmikroskop (cryo-EM) blev indviet ved ESRF, den
Cryo-EM afslører struktur og mekanisme for 5-HT3-receptorenGenerelt billede af 5-HT3-receptoren, som er lavet af 5 underenheder. Kredit:Hugues Nury, IBS/CNRS/ESRF I november 2017, et Titan Krios kryo-elektronmikroskop (cryo-EM) blev indviet ved ESRF, den -
 Ny forskning viser begrænsningerne af koordination i kemiBrint i sin plasmatilstand. Kredit:Alchemist-hp En almindelig antagelse i kemi er, at koordinationstallet for en katalysators overflade bestemmer reaktiviteten af den reaktion, den katalyserer.
Ny forskning viser begrænsningerne af koordination i kemiBrint i sin plasmatilstand. Kredit:Alchemist-hp En almindelig antagelse i kemi er, at koordinationstallet for en katalysators overflade bestemmer reaktiviteten af den reaktion, den katalyserer.
- Hvilken del af et atom er ansvarlig for at fremstille magnetfelter?
- Hvilken ændring frigiver energi i omgivelserne?
- Near Earth Objects - hvad venter forude?
- Vi studerede 309.544 patentansøgninger - og fandt ud af, at opfindelse stadig er en mandsverden
- Større skader på mobilhomeparken i Alabama midt i en tropisk storm
- Strålingsdetektor med den laveste støj i verden booster kvantearbejdet


