Hvad kan der siges om en kogepunkt væske?
Definition:
* En kogepunktvæske er en væske ved dens kogepunkt, temperaturen, hvorpå dens damptryk er lig med det omgivende atmosfæriske tryk.
Egenskaber:
* dynamisk ligevægt: Ved kogepunktet svarer hastigheden af flydende molekyler, der slipper ud i gasfasen, hastigheden af gasmolekyler, der vender tilbage til den flydende fase. Det er en tilstand af balance.
* Konstant temperatur: Temperaturen på en kogende væske forbliver konstant, selvom der kontinuerligt tilsættes varme. Denne varmeenergi bruges til at overvinde de intermolekylære kræfter, der holder væskemolekylerne sammen.
* bobler: Kogning er kendetegnet ved dannelsen af bobler i væsken. Disse bobler er fyldt med væskens damp, og de stiger op til overfladen og flugt.
* Energiindgang: Det kræver en masse energi at koge en væske. Den energi, der er nødvendig for at omdanne en væske til en gas, kaldes fordampningsvarmen.
* damptryk: Damptrykket af en væske er det tryk, der udøves af dets damp, når den er i ligevægt med væsken. På kogepunktet er damptrykket lig med det omgivende atmosfæriske tryk.
Faktorer, der påvirker kogepunktet:
* Intermolekylære kræfter: Væsker med stærkere intermolekylære kræfter (som hydrogenbinding) har højere kogepunkter.
* tryk: Kogepunktet falder, når trykket falder. Dette er grunden til, at vand koger ved en lavere temperatur i højere højder, hvor det atmosfæriske tryk er lavere.
* urenheder: Tilstedeværelsen af urenheder kan undertiden påvirke kogepunktet for en væske, især hvis urenhederne opløses i væsken.
Eksempler:
* Vand koger ved 100 ° C (212 ° F) ved standard atmosfærisk tryk.
* Ethanol koger ved 78 ° C (173 ° F) ved standard atmosfærisk tryk.
Kortfattet: Et kogepunktsvæske er en væske ved dens kogepunkt, hvor væsken og gasfaserne er i ligevægt, kendetegnet ved konstant temperatur, bobledannelse og en betydelig energiindgang.
Sidste artikelHvorfor har en natriumion ansvaret for 1 plus?
Næste artikelHvad er opløsningen af brintgas i palladium?
 Varme artikler
Varme artikler
-
 En måde at overvinde superkøling påa) HAADF-STEM billeder af replikafilm fremstillet ud fra prøver #1, #2, #11, og #13 af tetra-n-butylammonium 3-methylpentanoat (TBA-3MP) vandige opløsninger. I prøver #11 og #13, sølv nanopartikler 5-
En måde at overvinde superkøling påa) HAADF-STEM billeder af replikafilm fremstillet ud fra prøver #1, #2, #11, og #13 af tetra-n-butylammonium 3-methylpentanoat (TBA-3MP) vandige opløsninger. I prøver #11 og #13, sølv nanopartikler 5- -
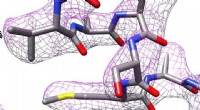 Elektron kryo-mikroskopi:Brug af billig teknologi til at producere billeder i høj opløsning3D-struktur af apoferritin produceret ved elektronkryo-mikroskopi. Kredit:Panagiotis Kastritis Biokemikere ved Martin Luther University Halle-Wittenberg (MLU) har brugt et standard elektronkryo-mi
Elektron kryo-mikroskopi:Brug af billig teknologi til at producere billeder i høj opløsning3D-struktur af apoferritin produceret ved elektronkryo-mikroskopi. Kredit:Panagiotis Kastritis Biokemikere ved Martin Luther University Halle-Wittenberg (MLU) har brugt et standard elektronkryo-mi -
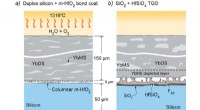 Materiale og belægningsproces for at beskytte keramiske deleGrafisk abstrakt. Kredit:DOI:10.1016/j.actamat.2021.117167 Post-pandemiske ferierejser var blandt de største historier i sommeren 2021, rejser spørgsmål om flyrejsers bidrag til drivhusgasemission
Materiale og belægningsproces for at beskytte keramiske deleGrafisk abstrakt. Kredit:DOI:10.1016/j.actamat.2021.117167 Post-pandemiske ferierejser var blandt de største historier i sommeren 2021, rejser spørgsmål om flyrejsers bidrag til drivhusgasemission -
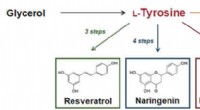 Tyrosin-chassis til bæredygtig, højtydende produktion af nyttige forbindelser i smarte gærcellerFigur 1:Betaxanthin-biosyntesevejen og nyttige forbindelser, der kan syntetiseres ud fra tyrosin. Kredit:Kobe University Kobe University-forskere har med succes udviklet et tyrosin-chassis (en stam
Tyrosin-chassis til bæredygtig, højtydende produktion af nyttige forbindelser i smarte gærcellerFigur 1:Betaxanthin-biosyntesevejen og nyttige forbindelser, der kan syntetiseres ud fra tyrosin. Kredit:Kobe University Kobe University-forskere har med succes udviklet et tyrosin-chassis (en stam


