Er hydrogenbindingen afhængig af pH?
* ph og ionisering: PH påvirker ioniseringstilstanden for molekyler. For eksempel kan en carboxylsyre (-cooh) miste en proton (H+) ved højere pH for at blive et carboxylation (-coo-). Denne ændring i ionisering påvirker evnen til at danne brintbindinger.
* Hydrogenbindingsdonorer og acceptorer: Hydrogenbindinger kræver både en hydrogenbindingsdonor (et hydrogenatom kovalent bundet til et stærkt elektronegativt atom som ilt eller nitrogen) og en brintbindingsacceptor (et elektronegativt atom med et ensomt par elektroner). Ionisering kan ændre tilgængeligheden af disse donorer og acceptorer.
Eksempler:
* Vand: Vandmolekyler danner let hydrogenbindinger med hinanden. Ved meget lav pH (høj surhedsgrad) vil vandmolekylerne imidlertid blive protoneret (H3O+), hvilket reducerer deres evne til at donere en hydrogenbinding.
* Proteiner: Aminosyrer i proteiner indeholder grupper som carboxylater (-coo-) og aminer (-NH2), der kan deltage i hydrogenbinding. Ændringer i pH kan påvirke ioniseringstilstanden for disse grupper, ændre deres evne til at danne hydrogenbindinger og dermed proteinets struktur og funktion.
* DNA: Den dobbelte helixstruktur af DNA er stærkt afhængig af brintbindinger mellem komplementære basepar. Ændringer i pH kan påvirke ioniseringen af disse baser, hvilket potentielt påvirker DNA -stabilitet.
Nøglepunkter:
* indirekte indflydelse: PH påvirker styrken af brintbindinger ved at ændre ioniseringstilstanden for molekyler, som igen påvirker tilgængeligheden af brintbindingsdonorer og acceptorer.
* specificitet: Effekten af pH på brintbindinger varierer afhængigt af de specifikke molekyler involveret.
I resumé, mens brintbindinger i sig selv ikke er direkte afhængige af pH, kan ioniseringstilstanden af molekyler, der er påvirket af pH, væsentligt påvirke deres evne til at danne og deltage i brintbinding.
 Varme artikler
Varme artikler
-
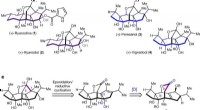 Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio
Kemikere syntetiserer perseanol for første gangen, Kemisk struktur, kulstofnummerering og ringsystembogstav tildeling for ryanodane (a) og isoryanodane (b) diterpener. c, Retrosyntetisk analyse af isoryanodane diterpen (+)-perseanol. [O], oxidatio -
 At omdanne madaffald til bioplastPå UC’s Institut for Kemi- og Procesteknik, Dr. Alex Yip leder forskning i omdannelse af madspild. Kredit:University of Canterbury En genial ny løsning, der bliver udviklet ved University of Cante
At omdanne madaffald til bioplastPå UC’s Institut for Kemi- og Procesteknik, Dr. Alex Yip leder forskning i omdannelse af madspild. Kredit:University of Canterbury En genial ny løsning, der bliver udviklet ved University of Cante -
 Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske
Enkeltcelleanalyse afslører heterogenitet i metaladsorptionKredit:LuckyStep/Shutterstock Biosorption er fjernelse af kontaminanter fra en prøve ved at adsorbere dem på overfladen af et biologisk materiale. Det forventes at give miljømæssige og økonomiske -
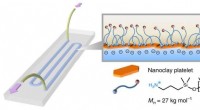 Bro over koblede farvande:Forskere 3-D-printer laboratorium med fuld væske på en chipNår to væsker - den ene indeholder nanoskala lerpartikler, en anden indeholdende polymerpartikler - er trykt på et glassubstrat, de kommer sammen ved grænsefladen mellem de to væsker og danner inden f
Bro over koblede farvande:Forskere 3-D-printer laboratorium med fuld væske på en chipNår to væsker - den ene indeholder nanoskala lerpartikler, en anden indeholdende polymerpartikler - er trykt på et glassubstrat, de kommer sammen ved grænsefladen mellem de to væsker og danner inden f
- Hvad er nogle andre navne til ædle gasser?
- New Orleans grønt efter Katrina afspejler den sociale demografi mere end orkanens indvirkning
- Hvem udviklede teorien om den isotermiske linje?
- Hvor mange squarmtr i en lineær meter?
- NASA estimerer den globale rækkevidde af atmosfæriske floder
- Facebook skærper politiske annonceregler op forud for EU-valget


