Hvad sker der med et atom af fluor F, når det danner ionisk binding, hvori har den samme elektronkonfiguration som ædelgasneon?
* fluorens naturlige tilstand: Fluor har 9 elektroner:2 i den første skal og 7 i den anden skal. Dette betyder, at det har 7 valenselektroner (elektroner i den yderste skal). Det er kun en elektron, der ikke har en fuld ydre skal som neon (som har 8).
* ionisk binding: Fluor er meget elektronegativ, hvilket betyder, at den har en stærk attraktion for elektroner. For at opnå en stabil octet (8 elektroner i sin ydre skal), vil den vinde et elektron fra et andet atom. Dette sker typisk, når det binder sig med et metal.
* Dannelse af fluorion ion: Når fluor får et elektron, bliver det negativt ladet. Dette skyldes, at det nu har 10 elektroner (9 originale + 1 opnået), men stadig kun 9 protoner. Dette negativt ladede fluoratom kaldes A fluorionion (f-) .
* neonkonfiguration: Ved at få en elektron bliver fluorens elektronkonfiguration 2, 8, der matcher den af den ædle gas neon. Denne fulde ydre skal gør fluorionen meget stabil.
Eksempel:
Overvej dannelsen af natriumfluorid (NAF):
* Natrium (NA) har 1 valenselektron og ønsker at miste det for at opnå en stabil konfiguration som neon.
* Fluor (F) ønsker at få et elektron for at opnå den samme stabile konfiguration.
Når de reagerer, mister natrium sin elektron og danner en positiv natriumion (Na+). Fluorgevinster, der elektron, danner en negativ fluorion ion (F-). Disse modsatte ladede ioner tiltrækker hinanden og danner en ionisk binding og den sammensatte NAF.
Kortfattet: Når fluor danner en ionisk binding, får den en elektron for at opnå den stabile elektronkonfiguration af neon og blive en fluorion (F-).
Sidste artikelHvad er nogle kovalente forbindelser af magnesium?
Næste artikelEr hydrogenbindingen afhængig af pH?
 Varme artikler
Varme artikler
-
 Multitasking-katalysatorenKredit:Chemical Communications, 2017, Nummer 98. Professor Takashi Ooi og hans team af forskere fra Nagoya University, Japan, har designet en katalysator, der udfører to opgaver i løbet af reaktio
Multitasking-katalysatorenKredit:Chemical Communications, 2017, Nummer 98. Professor Takashi Ooi og hans team af forskere fra Nagoya University, Japan, har designet en katalysator, der udfører to opgaver i løbet af reaktio -
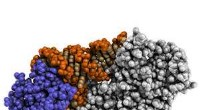 Nøglen til at udvide genetisk kode beskrevetEn illustration af biokemisk sammensætning af pyrrolysyl-tRNA syntetase (PylRS) kompleks, en af nøglerne til at udvide den genetiske kode. Kredit:Yale University Yale -forskere har beskrevet ato
Nøglen til at udvide genetisk kode beskrevetEn illustration af biokemisk sammensætning af pyrrolysyl-tRNA syntetase (PylRS) kompleks, en af nøglerne til at udvide den genetiske kode. Kredit:Yale University Yale -forskere har beskrevet ato -
 Udfordring forudsiger, hvordan metaller med komplekse former og fremstilling vil brydeMaterialeforsker Brad Boyce, arbejde med kolleger på Sandia National Laboratories, organiseret flere udfordringer for forskere, der arbejder på at forbedre forudsigelser for brud i duktile metaller. K
Udfordring forudsiger, hvordan metaller med komplekse former og fremstilling vil brydeMaterialeforsker Brad Boyce, arbejde med kolleger på Sandia National Laboratories, organiseret flere udfordringer for forskere, der arbejder på at forbedre forudsigelser for brud i duktile metaller. K -
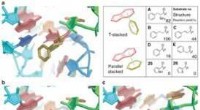 Hærprojekt kan føre til en ny klasse af højtydende materialerSyntetiske biologer, der arbejder på et amerikansk hærsprojekt, har udviklet et sæt designregler, der guider hvordan ribosomer, en cellestruktur, der danner protein, kunne føre til en ny klasse af syn
Hærprojekt kan føre til en ny klasse af højtydende materialerSyntetiske biologer, der arbejder på et amerikansk hærsprojekt, har udviklet et sæt designregler, der guider hvordan ribosomer, en cellestruktur, der danner protein, kunne føre til en ny klasse af syn
- Når luft er afkølet, hvad sker der med massen?
- Hvor i Canada findes naturgas?
- Fanged kænguruforskning kunne kaste lys over udryddelse
- Ikke-svage knuder styrker kulfiber:Nyt materiale skabt med grafenoxidflager
- Neutroner giver ny polering til olieforarbejdning og mere
- Hvorfor er en energipyramide formet som en pyramide?


