Sammenlignet med det rene vand har en vandig opløsning af calciumchlorid en?
* Højere kogepunkt: Calciumchlorid er et opløst stof, der opløses i vand, hvilket øger kogepunktet for opløsningen. Dette skyldes de øgede intermolekylære kræfter mellem vandmolekylerne og de opløste ioner.
* Nedre frysepunkt: De opløste ioner i opløsningen forstyrrer dannelsen af krystalgitterstrukturen af is, hvilket fører til et lavere frysepunkt.
* Højere osmotisk tryk: Tilstedeværelsen af opløste ioner øger det osmotiske tryk, hvilket er det krævede tryk for at forhindre strømning af vand på tværs af en semipermeabel membran.
* Højere elektrisk ledningsevne: Rent vand er en dårlig leder af elektricitet, men de opløste ioner i en calciumchloridopløsning gør det til en god leder.
Sammenfattende har en vandig opløsning af calciumchlorid højere kogepunkt, lavere frysepunkt, højere osmotisk tryk og højere elektrisk ledningsevne sammenlignet med rent vand.
 Varme artikler
Varme artikler
-
 Nyt værktøj ændrer spillet for heterogen materialemodelleringNREL-forskerne Francois Usseglio-Viretta (til venstre) og Nicholas Brunhart-Lupo bruger 3D-visualiseringslaboratoriet i Insight Center på NRELs Energy Systems Integration Facility til at arbejde på Mi
Nyt værktøj ændrer spillet for heterogen materialemodelleringNREL-forskerne Francois Usseglio-Viretta (til venstre) og Nicholas Brunhart-Lupo bruger 3D-visualiseringslaboratoriet i Insight Center på NRELs Energy Systems Integration Facility til at arbejde på Mi -
 Stor, krystallinske lipid stilladser bringer nye muligheder for protein, lægemiddelforskningUniversity of Illinois ingeniørprofessor Cecilia Leal, venstre, og kandidatstuderende Hojun Kim har udviklet en stor, krystallinsk lipidstruktur, der kan understøtte meget større proteiner og molekyle
Stor, krystallinske lipid stilladser bringer nye muligheder for protein, lægemiddelforskningUniversity of Illinois ingeniørprofessor Cecilia Leal, venstre, og kandidatstuderende Hojun Kim har udviklet en stor, krystallinsk lipidstruktur, der kan understøtte meget større proteiner og molekyle -
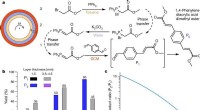 En ny måde at automatisere sekvenser af kemiske reaktionerFlertrins organiske synteser i koncentriske væskereaktorer. Kredit: Natur (2020). DOI:10.1038/s41586-020-2768-9 Et team af forskere fra Ulsan National Institute of Science and Technology i Korea
En ny måde at automatisere sekvenser af kemiske reaktionerFlertrins organiske synteser i koncentriske væskereaktorer. Kredit: Natur (2020). DOI:10.1038/s41586-020-2768-9 Et team af forskere fra Ulsan National Institute of Science and Technology i Korea -
 Hvordan tardigradens hemmeligheder kunne forbedre livreddende lægemidler som insulinSEM-billede af Milnesium tardigradum i aktiv tilstand. Kredit:PLoS ONE 7(9):e45682. doi:10.1371/journal.pone.0045682 UCLA-kemiker Heather Maynard måtte undre sig:Hvordan gør organismer som tardigra
Hvordan tardigradens hemmeligheder kunne forbedre livreddende lægemidler som insulinSEM-billede af Milnesium tardigradum i aktiv tilstand. Kredit:PLoS ONE 7(9):e45682. doi:10.1371/journal.pone.0045682 UCLA-kemiker Heather Maynard måtte undre sig:Hvordan gør organismer som tardigra
- Det tørreste sted på jorden:Chiles Atacama-ørken
- Mere præcis løsning til grænseoverskridende internetkøb
- Spin filtrering ved stuetemperatur med grafen
- Skulle sorte fagfolk være nødt til at vende tilbage til fjendtlige arbejdspladser med lempelse af …
- Hvad er en ulempe ved at bruge vindmøller i stedet fossile brændstoffer?
- Paris-showet genoplever Pompejis sidste forfærdelige timer


