Hvorfor er det, når et opløst stof tilsat til ren væske kogepunktet øges, og frysning falder?
Her er en sammenbrud af, hvorfor dette sker:
Kogepunkthøjde:
* damptryk sænkning: Når du tilsætter et opløsningsmiddel til et opløsningsmiddel, forstyrrer de opløste partikler opløsningsmiddelmolekylerne ved overfladen. Dette gør det sværere for opløsningsmiddelmolekylerne at flygte ind i dampfasen, hvilket fører til et lavere damptryk.
* Højere kogepunkt: For at en væske skal koges, skal dets damptryk være lig med det atmosfæriske tryk. Da damptrykket sænkes af tilstedeværelsen af opløstelsen, skal væsken nå en højere temperatur for at opnå denne balance. Derfor er kogepunktet forhøjet.
Frysningspunktdepression:
* forstyrrelse af krystalgitter: Når en flydende fryser, danner dens molekyler en regelmæssig, ordnet krystalgitter. Solute -partiklerne forstyrrer dette ordnede arrangement, hvilket gør det vanskeligere for opløsningsmiddelmolekylerne at danne en stabil krystal.
* Nedre frysepunkt: Fordi opløsningen griber ind i dannelsen af krystalgitteret, skal opløsningsmiddelmolekylerne afkøles til en lavere temperatur for at størkne. Dette resulterer i et lavere frysepunkt.
Nøglepunkter:
* Kolligative egenskaber: Disse egenskaber afhænger kun af koncentrationen af opløste partikler i opløsningen, ikke af den specifikke type opløst stof.
* Ikke-flygtige opløste stoffer: Forklaringerne ovenfor gælder primært for ikke-flygtige opløste stoffer (dem, der ikke let fordamper). Hvis opløstelsen er flygtig, skal dets eget damptryk også overvejes.
* elektrolytter: For opløste stoffer, der dissocieres i ioner (elektrolytter), forstørres virkningen på kogepunktforhøjelsen og frysepunktdepression, fordi der er flere partikler i opløsning.
Fortæl mig, hvis du gerne vil have flere detaljer eller eksempler!
 Varme artikler
Varme artikler
-
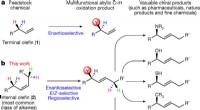 Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan
Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan -
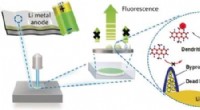 Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe
Fluorescensprobe viser fordelingen af aktive lithiumarter på lithiummetalanoderKredit:Wiley Batterier med metalliske lithium-anoder giver forbedret effektivitet sammenlignet med konventionelle lithium-ion-batterier på grund af deres højere kapacitet. Imidlertid, sikkerhedshe -
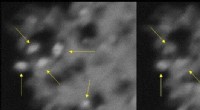 Usædvanlige nanopartikler kan gavne søgen efter at bygge en kvantecomputerPilene peger på, at titandioxid nanokrystaller lyser og blinker (venstre) og derefter falmer (højre). Kredit:Tewodros Asefa og Eliska Mikmekova Forestil dig små krystaller, der blinker som ildflue
Usædvanlige nanopartikler kan gavne søgen efter at bygge en kvantecomputerPilene peger på, at titandioxid nanokrystaller lyser og blinker (venstre) og derefter falmer (højre). Kredit:Tewodros Asefa og Eliska Mikmekova Forestil dig små krystaller, der blinker som ildflue -
 Forskere trykker regnbuefarvestoffer på skinnende chokoladeKredit:ETH Zürich ETH-forskere får chokolade til at skinne i regnbuefarver uden tilsætning af farvestoffer. De har fundet en måde at præge en speciel struktur på overfladen af chokoladen for at
Forskere trykker regnbuefarvestoffer på skinnende chokoladeKredit:ETH Zürich ETH-forskere får chokolade til at skinne i regnbuefarver uden tilsætning af farvestoffer. De har fundet en måde at præge en speciel struktur på overfladen af chokoladen for at
- Kan en stjerne have mindre end halvdelen af solmassen?
- Forskere præsenterer revolutionerende lysemitterende silicium
- Kondensatorbaseret arkitektur til AI-hardware acceleratorer
- Overvej en ensartet firkantet plade af side og masse m det øjeblik inerti dette om en akse vinkelre…
- Hvilken rocktype er forbundet med et miljø med høj energi?
- Nanorør-kompositter øger effektiviteten af næste generation af solceller


