Det rigtige orbitaldiagram over dette element svovl?
1. Elektronisk konfiguration:
* 1S² 2S² 2P⁶ 3S² 3P⁴
2. Orbital diagram:
* 1s: ↑ ↓
* 2s: ↑ ↓
* 2p: ↑ ↓ ↑ ↓ ↑ ↓
* 3s: ↑ ↓
* 3p: ↑ ↓ ↑ ↑
Forklaring:
* orbitaler og Hunds regel: Orbitaldiagrammet viser arrangementet af elektroner inden for hvert underskal. Hunds regel siger, at elektroner individuelt vil besætte hver orbital inden for et underskal, før de fordobles i en orbital.
* Pauli Ekskluderingsprincip: Hver orbital kan maksimalt holde to elektroner, og de skal have modsatte spins (en spin up, en spin ned).
Vigtige noter:
* underskaller: 'S' underskaller har en orbital, 'p' underskaller har tre orbitaler, og så videre.
* spin: Pilene repræsenterer spin på elektronerne. "↑" repræsenterer spin up, og "↓" repræsenterer spin ned.
Fortæl mig, hvis du gerne vil have en visuel repræsentation af dette diagram!
 Varme artikler
Varme artikler
-
 Elektrisk åle-inspireret enhed når 110 voltElektrisk ål-inspireret enhed når 110 volt:Dette billede viser den trykte, højspændingsimplementering af det kunstige elektriske organ. En 3-D bioprinter blev brugt til at afsætte arrays af gelprecurs
Elektrisk åle-inspireret enhed når 110 voltElektrisk ål-inspireret enhed når 110 volt:Dette billede viser den trykte, højspændingsimplementering af det kunstige elektriske organ. En 3-D bioprinter blev brugt til at afsætte arrays af gelprecurs -
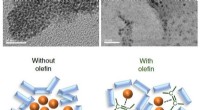 Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre),
Forøgelse af kemiske reaktioner i fast tilstandØverst:Elektronmikroskopiske billeder af palladium -nanopartikler i reaktionsblandingerne. Efter 99 minutters reaktion, palladiumkatalysatoren blev fundet aggregeret og deaktiveret selv (til venstre), -
 Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm
Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm -
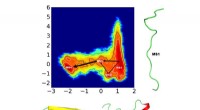 Ny metode fremskynder simuleringer, giver ny indsigt i proteinfoldningForskere søger at forstå proteinfoldning bedre for at helbrede fejlfoldningssygdomme, men denne utroligt komplekse proces kræver sofistikerede algoritmer til at identificere foldemekanismerne. Beregni
Ny metode fremskynder simuleringer, giver ny indsigt i proteinfoldningForskere søger at forstå proteinfoldning bedre for at helbrede fejlfoldningssygdomme, men denne utroligt komplekse proces kræver sofistikerede algoritmer til at identificere foldemekanismerne. Beregni
- Hvordan påvirker havstrømme kystklima?
- Milliardærers rigdomme når rekordhøjder under pandemi
- Hvor mange valenselektroner skal rummes i Lewis-strukturen for F2?
- Er en neutronstjerne i hovedsekvensen?
- Hvad er den empiriske formel for c12h12?
- Elegant teori viser, hvordan vand hjælper med at adskille ioner involveret i materialesyntese og -f…


