Hvorfor er kalium mere reaktiv end aluminium eller jern?
1. Ioniseringsenergi:
* lavere ioniseringsenergi: Kalium har en markant lavere første ioniseringsenergi end aluminium og jern. Dette betyder, at det kræver mindre energi at fjerne et elektron fra et kaliumatom til at danne en positiv ion (K+). Dette gør kalium mere tilbøjelige til at miste en elektron og deltage i kemiske reaktioner.
2. Elektropositivitet:
* Højere elektropositivitet: Kalium er meget elektropositiv, hvilket betyder, at det let mister elektroner til dannelse af positive ioner. Denne tendens stammer fra sin position i den periodiske tabel, idet den er i gruppe 1 (alkalimetaller). Alkalimetaller er kendt for deres stærke tendens til at miste en elektron for at opnå en stabil ædelgaskonfiguration.
3. Metallisk binding:
* svagere metallisk binding: Kalium har svagere metallisk binding sammenlignet med aluminium og jern. Dette betyder, at elektronerne i dens ydre skal holdes mindre tæt og lettere involveret i reaktioner.
4. Atomradius:
* Større atomradius: Kalium har en større atomradius end aluminium og jern. Denne større størrelse betyder, at det ydre elektron er længere væk fra kernen, der oplever mindre tiltrækning og bliver lettere fjernet.
Kortfattet:
Kombinationen af lav ioniseringsenergi, høj elektropositivitet, svagere metallisk binding og større atomradius gør kalium til et meget reaktivt element, hvilket let mister sit ydre elektron til dannelse af positive ioner. I modsætning hertil har aluminium og jern højere ioniseringsenergier, er mindre elektropositive og har stærkere metallisk binding, hvilket fører til deres lavere reaktivitet.
Sidste artikelAfbalanceret ligning af jern og klor?
Næste artikelHvilken ion vil mest sandsynligt danne i forbindelser fra magnesium?
 Varme artikler
Varme artikler
-
 Mærkning og påvisning af RNA -ændringerUndersøgelsens hovedforfattere (fra venstre):Molekylærbiolog Dr. Sebastian Leidel, biokemiker Katja Hartstock (hovedforfatter), molekylærbiolog Benedikt Nilges og biokemiker Professor Andrea Rentmeist
Mærkning og påvisning af RNA -ændringerUndersøgelsens hovedforfattere (fra venstre):Molekylærbiolog Dr. Sebastian Leidel, biokemiker Katja Hartstock (hovedforfatter), molekylærbiolog Benedikt Nilges og biokemiker Professor Andrea Rentmeist -
 En ny klasse af antibiotikakandidater til bekæmpelse af superbugsForskerholdet fra State Key Laboratory of Chemical Biology and Drug Discovery af PolyUs Department of Applied Biology and Chemical Technology (ABCT) udvikler Nusbiarylins, en ny klasse af antibiotikak
En ny klasse af antibiotikakandidater til bekæmpelse af superbugsForskerholdet fra State Key Laboratory of Chemical Biology and Drug Discovery af PolyUs Department of Applied Biology and Chemical Technology (ABCT) udvikler Nusbiarylins, en ny klasse af antibiotikak -
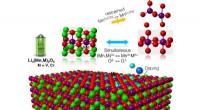 Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive
Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive -
 Dalian Coherent Light Source afslører nye dissociationskanaler i ethanfotokemiCH 3 , CH 2 og H-atomelimineringskanaler i fotodissociationen af ethan. Kredit:CHANG Yao At forstå og udnytte miljøet af udenjordiske kroppe er et centralt mål for planetarisk videnskab. Gas
Dalian Coherent Light Source afslører nye dissociationskanaler i ethanfotokemiCH 3 , CH 2 og H-atomelimineringskanaler i fotodissociationen af ethan. Kredit:CHANG Yao At forstå og udnytte miljøet af udenjordiske kroppe er et centralt mål for planetarisk videnskab. Gas
- Hvad er den kemiske formel for cesiumhybromit?
- AlphaZero vil bare gerne spille
- Havcirkulation er nøglen til at forstå usikkerheder i forudsigelser om klimaændringer
- Formen af en egenskab, der ser ud til at maskere en anden, kaldes hvad?
- NASAs næste laserkommunikationsdemo installeret, integreret
- Krympende partikelacceleratorer med kold plasma og en stor picnickurv


