Hvilket element, når det kombineres med fluor, ville sandsynligvis fra en ionisk forbindelse?
Elementer i gruppe 1 (alkalimetaller) og gruppe 2 (alkaliske jordmetaller) er de bedste kandidater til dette.
Her er hvorfor:
* gruppe 1: Disse metaller har kun en valenselektron, hvilket gør det relativt let for dem at miste denne elektron og danne en +1 -kation.
* gruppe 2: Disse metaller har to valenselektroner, så de har en tendens til at miste begge dele og danne en +2 -kation.
Eksempler:
* natrium (NA) Fra gruppe 1 ville danne natriumfluorid (NAF).
* calcium (CA) Fra gruppe 2 ville danne calciumfluorid (CAF₂).
Kortfattet: Elementer i gruppe 1 og gruppe 2 ville på grund af deres tendens til at miste elektroner sandsynligvis danne ioniske forbindelser med fluor.
 Varme artikler
Varme artikler
-
 Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm
Liquid nanofoam:En game changer til fremtidige fodboldhjelmeEt elektronisk mikroskopisk billede af nanofoam -materialet. Hver pore er 10 nm i diameter. Kredit:Weiyi Lu En flydende nanofoamforing, der gennemgår test, kan forlænge sikker brug af fodboldhjelm -
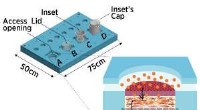 Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g
Rekonstruktion af hud på en chipMikrofluid hud-på-en-chip-enhed, der fungerer som et åbent system (A), en bioreaktor med låg (B), og et in vitro analysesystem udstyret med et åbent (C) eller et lukket skær (D). Nærbillede viser en g -
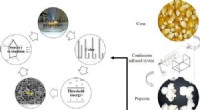 Store, velsmagende popcornkerner med infrarød tilberedningKredit:ACS Food Science &Technology (2022). DOI:10.1021/acsfoodscitech.2c00188 Ingen filmoplevelse er komplet uden popcorn, uanset om det er almindeligt, smørret eller overtrukket med sødt eller kr
Store, velsmagende popcornkerner med infrarød tilberedningKredit:ACS Food Science &Technology (2022). DOI:10.1021/acsfoodscitech.2c00188 Ingen filmoplevelse er komplet uden popcorn, uanset om det er almindeligt, smørret eller overtrukket med sødt eller kr -
 Videnskaben afslører hemmelighederne bag en mumies portræt(A) Portræt af en skægmand (Walters Art Museum #32.6), dateret c. 170-180 e.Kr. fra det romerske kejserlige Egypten; (B) Portrættet under ultraviolet lys. De lilla clavi på skuldrene ser pink-orange u
Videnskaben afslører hemmelighederne bag en mumies portræt(A) Portræt af en skægmand (Walters Art Museum #32.6), dateret c. 170-180 e.Kr. fra det romerske kejserlige Egypten; (B) Portrættet under ultraviolet lys. De lilla clavi på skuldrene ser pink-orange u
- Hvorfor er større dyr mere energieffektive? Et nyt svar på et århundreder gammelt biologisk pusle…
- Energiproducerende klud kan erstatte batterier i bærbare enheder
- Hvordan forhindrer friktion noget i at bevæge sig?
- I Namibia, 1533 Portugisiske skibsvrag relikvier gemt væk
- En kemisk cocktail af luftforurening i Beijing, Kina under COVID-19-udbruddet
- Hvornår blev Lunar Rover lavet?


