Er fosfortrihydrid en ionisk eller en kovalent binding?
* Elektronegativitetsforskel: Elektronegativitetsforskellen mellem fosfor (P) og brint (H) er relativt lille. Fosfor har en elektronegativitet på 2,19, og brint har en elektronegativitet på 2,20. Denne lille forskel indikerer, at elektronerne deles mellem atomerne snarere end at blive overført fuldt ud, hvilket er karakteristisk for kovalent binding.
* molekylær struktur: Ph₃ danner en pyramidal form med fosfor i midten og tre hydrogenatomer bundet til den. Denne molekylære struktur er typisk for kovalente forbindelser.
* Fysiske egenskaber: Ph₃ er en gas ved stuetemperatur og er relativt ureaktiv. Disse egenskaber er i overensstemmelse med kovalente forbindelser.
I modsætning hertil er ioniske forbindelser typisk:
* Har en stor elektronegativitetsforskel mellem elementerne.
* Form krystalgitter med stærke elektrostatiske interaktioner.
* Har høje smelte- og kogepunkter.
Selvom der muligvis er en lille grad af polaritet i P-H-bindingen på grund af den lille forskel i elektronegativitet, er den samlede karakter af bindingen i fosfortrihydrid kovalent .
Sidste artikelHvad er densiteten af diorit?
Næste artikelHvad er den korrekte forbindelse til FEI3?
 Varme artikler
Varme artikler
-
 Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd
Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd -
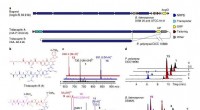 Forskere opdager en ny bakteriel resistensmekanisme mod peptidantibiotikaen, BGCerne af bogorol fra B. laterosporus DSM 25 og ATCC 9141, såvel som tridecaptin A og tridecaptin B fra P. polymyxa CICC 10580. BogQ fra stammen DSM 25 og den fra stammen ATCC 9141 deler 85 proce
Forskere opdager en ny bakteriel resistensmekanisme mod peptidantibiotikaen, BGCerne af bogorol fra B. laterosporus DSM 25 og ATCC 9141, såvel som tridecaptin A og tridecaptin B fra P. polymyxa CICC 10580. BogQ fra stammen DSM 25 og den fra stammen ATCC 9141 deler 85 proce -
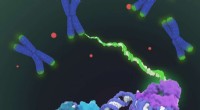 Langt søgt struktur af telomerase baner vej for nye lægemidler til aldring, KræftVist er den rumfyldende model af human telomerase-holoenzymstruktur bestemt ved kryo-elektronmikroskopi (cryo-EM). Telomerase katalyserer syntesen af telomerisk DNA (grøn) i enderne af kromosomerne
Langt søgt struktur af telomerase baner vej for nye lægemidler til aldring, KræftVist er den rumfyldende model af human telomerase-holoenzymstruktur bestemt ved kryo-elektronmikroskopi (cryo-EM). Telomerase katalyserer syntesen af telomerisk DNA (grøn) i enderne af kromosomerne -
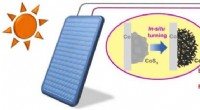 Ny elektrokatalysator udviklet til biomasseopgradering og brintgenereringDen fotovoltaiske elektrokatalyse til biomasseopgradering og brintgenerering. Kredit:NIMTE Prof. Zhang Jians team ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kine
Ny elektrokatalysator udviklet til biomasseopgradering og brintgenereringDen fotovoltaiske elektrokatalyse til biomasseopgradering og brintgenerering. Kredit:NIMTE Prof. Zhang Jians team ved Ningbo Institute of Materials Technology and Engineering (NIMTE) under det kine
- Hvad er en stor krop af sten eller gas, der kredserer?
- Ansættelse af kvindelige politibetjente hjælper kvinder med at rapportere vold, seksuelle overgreb…
- Hvilken varmeenergi overført gennem et stof ved direkte molekylær kontakt?
- Hvilken type energi udgør mest det interne et solidt stof?
- Hvad er forskellene mellem aktivering og deaktiverende grupper i elektrofillisk aromatisk substituti…
- Hvilken leder har ikke strøm under normal drift?


