Bortrichlorid er gas, men nitrogenvæske Hvorfor?
Her er en sammenbrud:
bor trichlorid (BCL 3 ):
* struktur: Bcl 3 Har en trigonal plan struktur med bor i midten og tre kloratomer omkring det.
* Polaritet: B-CL-bindingerne er polære på grund af elektronegativitetsforskellen mellem bor og klor. Imidlertid er selve molekylet ikke -polært, fordi de individuelle bindingsdipoler annullerer hinanden.
* Intermolekylære kræfter: De eneste signifikante intermolekylære kræfter, der er til stede i BCL 3 er London Dispersion Forces (også kendt som Van der Waals Forces), som er svage.
nitrogen (n 2 ):
* struktur: N 2 er et diatomisk molekyle med en tredobbelt binding mellem nitrogenatomerne.
* Polaritet: N≡n -bindingen er ikke -polær, fordi elektronegativiteten af begge nitrogenatomer er den samme.
* Intermolekylære kræfter: Mens n 2 er ikke -polær, det har stærkere London -spredningskræfter end BCL 3 . Dette skyldes den større elektronsky omkring nitrogenmolekylet, hvilket fører til større midlertidige dipoler.
Nøgleforskelle:
* styrke af intermolekylære kræfter: Nitrogen har stærkere London -spredningskræfter end bortrichlorid på grund af dets større elektronsky og tredobbelt binding.
* molekylvægt: Nitrogen (n 2 ) har en højere molekylvægt end bortrichlorid (BCL 3 ), som også bidrager til stærkere London -spredningskræfter.
Disse stærkere intermolekylære kræfter i nitrogen er den primære årsag til, at det eksisterer som en væske ved stuetemperatur, mens bortrichlorid er en gas.
 Varme artikler
Varme artikler
-
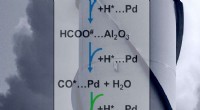 Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B
Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B -
 Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af
Pentacenderivat har 100 gange mere lysholdbarhed end konventionelle produkterLysustabilitet er en vigtig faktor, der forhindrer organiske halvledere i at blive implementeret. Forskere fra Osaka Metropolitan University demonstrerede, at den ultrahurtige intersystem-krydsning af -
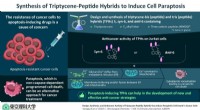 Programmeret celledød i cancerceller:Overvinde resistens gennem paraptose-inducerende forbindelserForskere fra Tokyo University of Science har udviklet nye komplekse peptidhybrider, som kan inducere en type programmeret celledød kaldet paraptose i apoptose-resistente cancerceller. Kredit:Tokyo Uni
Programmeret celledød i cancerceller:Overvinde resistens gennem paraptose-inducerende forbindelserForskere fra Tokyo University of Science har udviklet nye komplekse peptidhybrider, som kan inducere en type programmeret celledød kaldet paraptose i apoptose-resistente cancerceller. Kredit:Tokyo Uni -
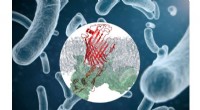 Ny funktionel indsigt i proteinkompleks, muligt nyt mål for antibiotikaProteinkomplekset (rødt) i bakteriens ydre membran. Kredit:Utrecht University Faculty of Science Forskere ved Utrecht Universitet har fået ny indsigt i strukturen og funktionen af et proteinkomp
Ny funktionel indsigt i proteinkompleks, muligt nyt mål for antibiotikaProteinkomplekset (rødt) i bakteriens ydre membran. Kredit:Utrecht University Faculty of Science Forskere ved Utrecht Universitet har fået ny indsigt i strukturen og funktionen af et proteinkomp
- Hvad er den kemiske tilstand af svovl?
- CEO politisk aktivisme:Jobsøgende vil have chefer, der tager stilling
- Atomcarbon indeholder hvor mange uparrede elektroner i henhold til regel?
- Roman Space Telescope vil også finde sorte huller
- Hvad er to slags skorpe, som en tektonisk plade kan indeholde?
- Bali vulkanaske driver 7,7 miles høj, lufthavn lukket 3. dag


