Hvor mange mol chloridioner er i 0,2520 g aluminiumchlorid?
1. Bestem formlen for aluminiumchlorid:
* Aluminium har en +3 ladning (al³⁺)
* Chlorid har en -1 -ladning (CL⁻)
* For at afbalancere anklagerne er formlen alcl₃
2. Beregn den molære masse af aluminiumchlorid:
* Al:26,98 g/mol
* Cl:35,45 g/mol
* Molmasse Alcl₃ =26,98 + (3 * 35,45) =133,33 g/mol
3. Konverter massen af aluminiumchlorid til mol:
* Mol =masse / molær masse
* Mol Alcl₃ =0,2520 g / 133,33 g / mol =0,00189 mol
4. Bestem molforholdet mellem chloridioner og aluminiumchlorid:
* Fra formlen Alcl₃ ser vi, at der er 3 mol cl⁻ioner for hver 1 mol alcl₃.
5. Beregn molen af chloridioner:
* Mol Cl⁻ =(mol Alcl₃) * (molforhold på CL⁻/ALCL₃)
* Mol Cl⁻ =0,00189 mol * 3 = 0,00567 mol
Derfor er der 0,00567 mol chloridioner i 0,2520 g aluminiumchlorid.
 Varme artikler
Varme artikler
-
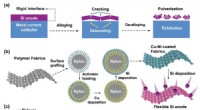 Forskere foreslår et fleksibelt interface-design til silicium-grafit dual-ion batteri(a) Skematisk illustration af den strukturelle skade på siliciumanode med et stift interface -design. (b) Fremstillingsproces af siliciumanode med feksibelt interface-design på det bløde nylonsubstrat
Forskere foreslår et fleksibelt interface-design til silicium-grafit dual-ion batteri(a) Skematisk illustration af den strukturelle skade på siliciumanode med et stift interface -design. (b) Fremstillingsproces af siliciumanode med feksibelt interface-design på det bløde nylonsubstrat -
 Nyt batteri tapper kuldioxid opDette scanningselektronmikroskopbillede viser carbonkatoden i et kuldioxidbaseret batteri fremstillet af MIT-forskere, efter at batteriet var afladet. Det viser opbygningen af kulstofforbindelser på
Nyt batteri tapper kuldioxid opDette scanningselektronmikroskopbillede viser carbonkatoden i et kuldioxidbaseret batteri fremstillet af MIT-forskere, efter at batteriet var afladet. Det viser opbygningen af kulstofforbindelser på -
 Video:Hvorfor laver de ikke længere klasse B ahornsirupKredit:The American Chemical Society Er du en klasse B ahornsirup fan? For mange ahornsirup-kendere var klasse B altid den bedste sirup. Den er mørk, karamelagtig, rig, kompleks. Men det kan man de
Video:Hvorfor laver de ikke længere klasse B ahornsirupKredit:The American Chemical Society Er du en klasse B ahornsirup fan? For mange ahornsirup-kendere var klasse B altid den bedste sirup. Den er mørk, karamelagtig, rig, kompleks. Men det kan man de -
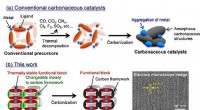 En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
En ny synteserute for alternative katalysatorer af ædelmetallerSynteseskemaer af (a) konventionelle carbonholdige katalysatorer og (b) dette arbejde for ordnede carbonholdige rammer. Kredit:Hirotomo Nishihara Forskere har udviklet en ny synteserute for altern
- Hvorfor buffer modstå ændringer i PH, når en lille mængde syre eller base tilsættes?
- Sanktioneret,
- Unik forudsigelse af modificeret tyngdekraft udfordrer teorien om mørkt stof
- Hvilke salte erstatter bedst natron?
- Hvilket stof hedder ikke elektricitet godt kaldes?
- Hvad er strømmen i et 140-W elektrisk tæppe tilsluttet 120-V-stikkontakt?


