Hvilket element har et krystallinsk gitter, gennem hvilket elektroner flyder frit?
Her er hvorfor:
* Metallisk binding: Kobber udviser sammen med andre metaller metallisk binding. I denne type binding delokaliseres de ydre valenselektroner og danner et "hav" af elektroner, der kan bevæge sig frit gennem hele gitteret.
* Krystallinsk struktur: Kobber har en ansigt-centreret kubisk (FCC) krystalstruktur, som giver et regelmæssigt og gentagne arrangement af atomer. Denne struktur giver mulighed for effektiv elektronmobilitet.
* Høj elektrisk ledningsevne: Den frie bevægelse af elektroner i kobbergitteret er grunden til, at kobber er en fremragende leder af elektricitet.
Mens andre metaller også har fritflydende elektroner i deres krystallinske strukturer, er kobber især kendt for sin høje elektriske ledningsevne, hvilket gør det til et meget anvendt materiale i elektriske ledninger og komponenter.
Sidste artikelEr kaliumatom, og en fluor er kovalent eller ionisk binding?
Næste artikelEr natriumcarbonat en vandig eller et fast stof?
 Varme artikler
Varme artikler
-
 Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc
Tegn på udbrændthed kan påvises i svedBold-og-stik-model af cortisol (hydrocortison) molekylet. Kredit:Public Domain EPFL ingeniører, arbejder i samarbejde med startup Xsensio, har udviklet et bærbart system, der løbende kan måle konc -
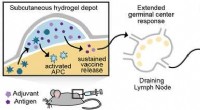 Injicerbar hydrogel kan en dag føre til mere effektive vaccinerKredit:American Chemical Society Vacciner har begrænset spredningen af flere infektionssygdomme, såsom kopper, polio og mæslinger. Imidlertid, vacciner mod visse sygdomme, inklusive HIV-1, influ
Injicerbar hydrogel kan en dag føre til mere effektive vaccinerKredit:American Chemical Society Vacciner har begrænset spredningen af flere infektionssygdomme, såsom kopper, polio og mæslinger. Imidlertid, vacciner mod visse sygdomme, inklusive HIV-1, influ -
 Nudler beriget med kostfibre af avanceret teknologi forbliver velsmagendeFigur 1:Grafisk repræsentation af de (venstre) eksperimentelle parametre og de (højre) attributter studeret som en del af denne forskning. Kredit:National University of Singapore NUS-fødevareforsk
Nudler beriget med kostfibre af avanceret teknologi forbliver velsmagendeFigur 1:Grafisk repræsentation af de (venstre) eksperimentelle parametre og de (højre) attributter studeret som en del af denne forskning. Kredit:National University of Singapore NUS-fødevareforsk -
 Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di
Forskere afkoder dynamikken i den største proteinnedbrydende maskine i atomare detaljerKredit:CC0 Public Domain Protein nanomaskiner lavet af flere proteinmolekyler er meget dynamiske under deres handlinger på deres funktionelle mål, nogle gange kaldet substrater. Dynamikken af di


