Hvor mange gram sølvchlorid dannes, når 10,0 g nitrat reagerer med 15,0 bariumchlorid?
1. Skriv den afbalancerede kemiske ligning:
Agno₃ (aq) + bacl₂ (aq) → 2agcl (s) + ba (no₃) ₂ (aq)
2. Bestem den begrænsende reaktant:
* Beregn molen for hver reaktant:
* Mol Agno₃ =(10,0 g) / (169,87 g / mol) =0,0589 mol
* Mol bacl₂ =(15,0 g) / (208,23 g / mol) =0,0720 mol
* Sammenlign molforholdet: Den afbalancerede ligning viser et forhold på 1:1 mol mellem agno₃ og bacl₂. Da vi har færre mol agno₃, er det den begrænsende reaktant.
3. Beregn molen for AGCL dannet:
* Fra den afbalancerede ligning producerer 1 mol agno₃ 2 mol AGCl.
* Mol AgCl =(0,0589 mol agno₃) * (2 mol AgCl / 1 mol agno₃) =0,118 mol AgCl
4. Beregn massen af AGCL dannet:
* Masse AgCl =(0,118 mol) * (143,32 g/mol) = 16,9 g AgCl
Derfor dannes 16,9 gram sølvchlorid (AGCL).
 Varme artikler
Varme artikler
-
 Billedteknologier øger fokus på gerningsstederKredit:European Cooperation in Science and Technology (COST) Kombinationen af flere billeder og banebrydende teknologi hjælper retsmedicin med at give retshåndhævende myndigheder, juryer og rets
Billedteknologier øger fokus på gerningsstederKredit:European Cooperation in Science and Technology (COST) Kombinationen af flere billeder og banebrydende teknologi hjælper retsmedicin med at give retshåndhævende myndigheder, juryer og rets -
 Bedre sammen:Sammensmeltet mikroskop giver et hidtil uset kig på biologiske processerDe hurtige bevægelser af Rab11-partikler kan tydeligt afbildes med det nye øjeblikkelige TIRF-SIM-mikroskop. Kredit:Hari Shroff, National Institute of Biomedical Imaging and Bioengineering Forsker
Bedre sammen:Sammensmeltet mikroskop giver et hidtil uset kig på biologiske processerDe hurtige bevægelser af Rab11-partikler kan tydeligt afbildes med det nye øjeblikkelige TIRF-SIM-mikroskop. Kredit:Hari Shroff, National Institute of Biomedical Imaging and Bioengineering Forsker -
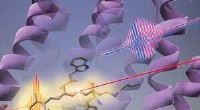 Proteinændringer går forud for fotoisomerisering af retinal kromoforFigur 1:RIKEN-forskere har fundet ud af, at lys (lang rød linje) først får proteinets form (lilla hvirvler) til at ændre sig, før den retinale kromofor (stick-lignende struktur) i bacteriorhodopsin ge
Proteinændringer går forud for fotoisomerisering af retinal kromoforFigur 1:RIKEN-forskere har fundet ud af, at lys (lang rød linje) først får proteinets form (lilla hvirvler) til at ændre sig, før den retinale kromofor (stick-lignende struktur) i bacteriorhodopsin ge -
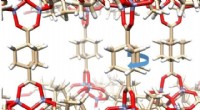 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
- System transformerer 3D-strukturen af et protein til et 2D-kontaktkort
- Hvad vil der ske, hvis de bevægelige gasser af en raket har større masse og hastighed?
- Mega docking-bibliotek klar til at fremskynde opdagelse af lægemidler
- Hvilken overgang kan repræsentere et atom, der udsender en foton med 10,2 energi?
- Genomisk analyse kaster lys over, hvordan søgræsser erobrede havet
- Hvem bliver en helt? Det er mere end blot personlighedstræk


