Hvorfor er hydrogen uopløselig i vand?
Her er hvorfor:
* svage intermolekylære kræfter: Hydrogengas (H₂) er ikke -polært, mens vand er meget polært. Dette betyder, at der er en svag interaktion mellem brint og vandmolekyler. Manglen på stærke attraktive kræfter begrænser opløseligheden af brint i vand.
* lav molekylvægt: Hydrogen har en meget lav molekylvægt, hvilket bidrager til dens dårlige opløselighed. Mindre molekyler har en tendens til at være mere opløselige, men Hydrogens lille størrelse gør det mindre sandsynligt, at det interagerer med vandmolekyler.
Det er dog vigtigt at bemærke:
* opløselighed afhænger af forholdene: Opløseligheden af brint i vand øges ved højere tryk og lavere temperaturer.
* noget brint kan opløses: Mens mængden af brint, der opløses i vandet, er relativt lille, er den ikke helt ubetydelig.
I sammendraget, mens brint ikke er meget opløseligt i vand, er det heller ikke helt uopløseligt. De svage intermolekylære kræfter og lav molekylvægt bidrager til dens dårlige opløselighed.
 Varme artikler
Varme artikler
-
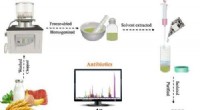 Registrering af spormængder af flere klasser af antibiotika i fødevarerKredit:American Chemical Society Udbredt brug af antibiotika i menneskers sundhedspleje og husdyrhold har ført til, at spormængder af stofferne ender i fødevarer. Langtidsforbrug kan forårsage sun
Registrering af spormængder af flere klasser af antibiotika i fødevarerKredit:American Chemical Society Udbredt brug af antibiotika i menneskers sundhedspleje og husdyrhold har ført til, at spormængder af stofferne ender i fødevarer. Langtidsforbrug kan forårsage sun -
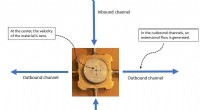 Strækning og flow:Forskning belyser usædvanlige egenskaber ved kendte materialerDen udvidede strøm blev genereret i den udgående kanal. Kredit:OIST Tandpasta, ansigtscremer, hårgelé, mayonnaise og ketchup er husholdningsartikler, som de fleste mennesker ikke tænker to gange o
Strækning og flow:Forskning belyser usædvanlige egenskaber ved kendte materialerDen udvidede strøm blev genereret i den udgående kanal. Kredit:OIST Tandpasta, ansigtscremer, hårgelé, mayonnaise og ketchup er husholdningsartikler, som de fleste mennesker ikke tænker to gange o -
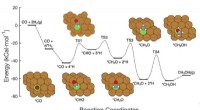 Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne
Machine learning framework ID'er mål til forbedring af katalysatorerDenne grafik viser syvtrins reaktionsvejen for CO-hydrogenering til methanol over kobberbaserede katalysatorer, inklusive reaktanterne på hvert trin, skematiske atomarrangementer af mellemprodukterne -
 ArtSea Ink:en farverig, tangbaseret blæk til 3D-printGlimmerpulver blev spredt i alginatopløsninger for at gøre levende, perlemorsfarvede blæk til 3D-print. Kredit:Tilpasset fra ACS Omega Nogle kunstnere omfavner 3D-print som et nyt medie, giver dem
ArtSea Ink:en farverig, tangbaseret blæk til 3D-printGlimmerpulver blev spredt i alginatopløsninger for at gøre levende, perlemorsfarvede blæk til 3D-print. Kredit:Tilpasset fra ACS Omega Nogle kunstnere omfavner 3D-print som et nyt medie, giver dem


