Hvorfor har berylliumchlorid mere kovalent karakter end bariumchlorid?
* mindre størrelse og højere ladningstæthed af beryllium: Beryllium er et meget mindre atom end barium. Dette betyder, at den positive ladning af berylliumion er koncentreret over et mindre område, hvilket skaber en højere ladningstæthed. Denne stærke positive ladning tiltrækker klorsky af klor mere effektivt, hvilket fører til en større grad af kovalent karakter.
* Højere elektronegativitetsforskel: Elektronegativitetsforskellen mellem beryllium og klor er mindre end den mellem barium og klor. Denne forskel er et mål for et atomens tendens til at tiltrække elektroner. En mindre elektronegativitetsforskel indikerer en mere kovalent karakter.
* Polariserbarhed af kationen: Berylliumion (Be²⁺) er meget mere polariserbar end bariumion (ba²⁺). Dette betyder, at elektronskyen af beryllium lettere kan forvrænges ved den negative ladning af klorionen, hvilket fører til en større grad af kovalent karakter.
Sammenfattende bidrager den mindre størrelse, højere ladningstæthed og større polariserbarhed af beryllium kombineret med den mindre elektronegativitetsforskel mellem beryllium og klor, den mere kovalente karakter af berylliumchlorid sammenlignet med bariumchlorid.
Bemærk: Det er vigtigt at huske, at begrebet "ionisk" eller "kovalent" ofte er et spektrum, og mange forbindelser udviser egenskaber for begge. Mens berylliumchlorid udviser mere kovalent karakter, er det ikke strengt en kovalent forbindelse og har stadig nogle ioniske egenskaber.
 Varme artikler
Varme artikler
-
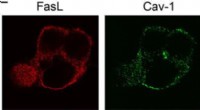 Forskere finder en måde at udsætte celledød påPlaceringen af fluorescensmærkede Fas-ligander (Fas-L) og caveolin (Cav-1) i cellen. Det sidste billede er overlapningen af Fas-L og Cav-1 (flet) kanalerne. Fremstillet ved laser konfokal scanning
Forskere finder en måde at udsætte celledød påPlaceringen af fluorescensmærkede Fas-ligander (Fas-L) og caveolin (Cav-1) i cellen. Det sidste billede er overlapningen af Fas-L og Cav-1 (flet) kanalerne. Fremstillet ved laser konfokal scanning -
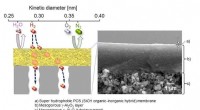 Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve
Ny brintbrændstofrensningsmembran baner vejen for en grønnere fremtidEt tværsnitsbillede af selektiv hydrogengennemtrængning i en superhydrofob membran dannet på en porøs rørformet understøtning. Kredit:Yuji Iwamoto fra Nagoya Institute of Technology Brint er bleve -
 Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud
Et termisk styringsmateriale, der reagerer på varme eller kulde ved at folde eller folde ud uden be…Inspireret af Mimosa pudica-blade vælger enheden intelligent den rigtige termiske styringstilstand ved at modulere dens morfologi. Kredit:Quan Zhang Et team af forskere ved Nankai University har ud -
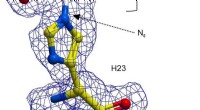 Kemikere viser, at det katalytiske udvalg af enzymer kan udvidesEn kugle-og-stik-repræsentation af H23 fra BH32 hæmmet med 2-bromacetophenon, farvet efter atomtype med H23 carbonatomer i gul og acetophenon carboner i hvid. Klar FEM elektrondensitet (blå, konturere
Kemikere viser, at det katalytiske udvalg af enzymer kan udvidesEn kugle-og-stik-repræsentation af H23 fra BH32 hæmmet med 2-bromacetophenon, farvet efter atomtype med H23 carbonatomer i gul og acetophenon carboner i hvid. Klar FEM elektrondensitet (blå, konturere
- Hvad gør Hubble -teleskop i atmosfæren?
- Hvordan adskiller den halvmåne fase, der går forud for New Moon, fra følger måne?
- Hvor meget forstørrelse er nødvendig for at se Jupiter tydeligt gennem et teleskop?
- Fjerne gigantiske planeter dannes anderledes end fejlslagne stjerner
- Hvad betyder Bauxite inden for videnskab?
- Ny teknologi bryder igennem tegnsprogsbarrierer


