Når et calciumatom mister sine valenselektroner, har den dannede ion en elektronkonfiguration, der er den samme som?
1. Calciums elektronkonfiguration
* Calcium (CA) har et atomnummer på 20, hvilket betyder, at det har 20 protoner og 20 elektroner.
* Dens elektronkonfiguration er:1S² 2S² 2p⁶ 3S² 3P⁶ 4S²
2. Mister valenselektroner
* Calcium er i gruppe 2 i den periodiske tabel, hvilket betyder, at den har to valenselektroner (elektronerne i den yderste skal, 4S -orbitalen i dette tilfælde).
* Når calcium mister disse to valenselektroner, bliver det en positivt ladet ion (kation).
3. Calciumions elektronkonfiguration
* Calciumion (Ca²⁺) har nu 18 elektroner.
* Dens elektronkonfiguration bliver:1S² 2s² 2p⁶ 3S² 3P⁶
4. Lighed med argon
* Bemærk, at elektronkonfigurationen af Ca²⁺ er nøjagtig den samme som elektronkonfigurationen af den ædle gas argon (AR), som også har 18 elektroner:1S² 2s² 2p⁶ 3S² 3P⁶
Konklusion
Når et calciumatom mister sine to valenselektroner, har den resulterende calciumion (Ca²⁺) en elektronkonfiguration, der er den samme som for den ædle gas argon (AR). Dette er et almindeligt fænomen blandt elementer, især dem i de to første grupper og den sidste gruppe (halogenerne) af den periodiske tabel. De har en tendens til at vinde eller miste elektroner for at opnå en stabil elektronkonfiguration som en ædelgas.
 Varme artikler
Varme artikler
-
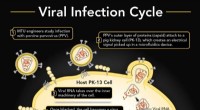 Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir
Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir -
 Titan -supercomputer analyserer bakterielt fotosyntetisk systemATP-hydrolysedrevet rotation af den centrale stilk i ATP-syntasen af V-typen af bakterierne Enterococcus hirae skildrer kemomekanisk kobling af molekylmotoren. Disse simuleringer blev udført på Ti
Titan -supercomputer analyserer bakterielt fotosyntetisk systemATP-hydrolysedrevet rotation af den centrale stilk i ATP-syntasen af V-typen af bakterierne Enterococcus hirae skildrer kemomekanisk kobling af molekylmotoren. Disse simuleringer blev udført på Ti -
 En grønnere proces til at udvinde forbindelser fra landbrugs- og madaffaldPlukkede æbler på frugthave. Kredit:Jill Wellington fra Pixabay Forskere ved University of Adelaide har identificeret en grønnere proces til udvinding af sundhedsfremmende molekyler fundet i landb
En grønnere proces til at udvinde forbindelser fra landbrugs- og madaffaldPlukkede æbler på frugthave. Kredit:Jill Wellington fra Pixabay Forskere ved University of Adelaide har identificeret en grønnere proces til udvinding af sundhedsfremmende molekyler fundet i landb -
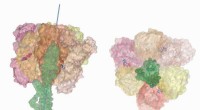
 Forskning bryder ny vej i forståelsen af, hvordan en molekylær motor genererer kraftKredit:CC0 Public Domain Et team af biofysikere fra University of Massachusetts Amherst og Penn State College of Medicine satte sig for at tackle det langvarige spørgsmål om naturen af kraftgene
Forskning bryder ny vej i forståelsen af, hvordan en molekylær motor genererer kraftKredit:CC0 Public Domain Et team af biofysikere fra University of Massachusetts Amherst og Penn State College of Medicine satte sig for at tackle det langvarige spørgsmål om naturen af kraftgene
- Hvor meget brændstof brændes på Shuttle Lift Off?
- Gå ikke ud fra, at sprog eller dialekt er låst til et bestemt sted
- Hvor mange mol natriumioner og chlorid er til stede i 1 liter en 1M opløsningsklorid?
- Hvad er hastigheden for en bølgelængde på 5 meter?
- Hvordan apps og andre onlineværktøjer udfordrer racistiske angreb
- Hvad er de to måder stjerner klassificeret på?


