Hvad indeholder polære bindinger P4 H2S NO2 S22?
* p₄ (tetraphosphor) :Dette molekyle består af fire fosforatomer bundet sammen i en tetrahedral form. Da bindingerne er mellem identiske atomer (P-P), er de ikke-polære. Derfor indeholder P₄ ikke polære obligationer.
* h₂s (hydrogensulfid) :Dette molekyle har en bøjet form på grund af de ensomme par på svovlatomet. De svovl-hydrogenbindinger (S-H) er polære, fordi svovl er mere elektronegativ end brint. Derfor indeholder H₂S polære obligationer.
* no₂ (nitrogen dioxid) :Dette molekyle har en bøjet form med et ensomt par på nitrogenatomet. Nitrogen-iltbindingerne (N-O) er polære, fordi ilt er mere elektronegativt end nitrogen. Derfor indeholder ingen polære obligationer.
* s₂₂ (Disulfur) :Dette molekyle har en lineær form med en svovl-svovl dobbeltbinding. Svovl-svovlbindingen (S =S) er ikke-polær, da atomerne er identiske. Derfor indeholder S₂₂ ikke polære obligationer.
Kortfattet:
* polære obligationer er til stede i: H₂s og ingen₂
* Ikke -polære obligationer er til stede i: P₄ og S₂₂
 Varme artikler
Varme artikler
-
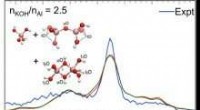 Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får
Aluminiumskomplekser identificeret via vibrationsfingeraftrykRamanspektre af opløsninger sammensat af en aluminatmonomer og to dimere arter. Vibrationsbånd forudsagt af ab-initio molekylær dynamik (AIMD) vist i rødt og grønt. Overlappende IR- og Raman-bånd får -
 Spor af opiater fundet i antikke cypriotiske fartøjerBase-ring juglet ligner frøhovedet af en opiumsvalmue Kredit:British Museum Forskere ved University of York og British Museum har opdaget spor af opiater, der er bevaret inde i et karakteristisk k
Spor af opiater fundet i antikke cypriotiske fartøjerBase-ring juglet ligner frøhovedet af en opiumsvalmue Kredit:British Museum Forskere ved University of York og British Museum har opdaget spor af opiater, der er bevaret inde i et karakteristisk k -
 Den nye analysemetode i rekordhøj hastighed DNA-analyseanordningSynergistisk PCR, en ny metode til DNA-analyse udviklet af Curiosity Diagnostics i samarbejde med Institute of Physical Chemistry ved det polske videnskabsakademi i Warszawa, kan udføres på bredt tilg
Den nye analysemetode i rekordhøj hastighed DNA-analyseanordningSynergistisk PCR, en ny metode til DNA-analyse udviklet af Curiosity Diagnostics i samarbejde med Institute of Physical Chemistry ved det polske videnskabsakademi i Warszawa, kan udføres på bredt tilg -
 Papirbaseret teknologi fremmer tidligere opdagelse af kræftWenji Dong. Kredit:WSU Forskere fra Washington State University har udviklet en teknologi, der er mere end 30 gange mere følsom end nuværende laboratoriebaserede tests til at finde biomarkører for
Papirbaseret teknologi fremmer tidligere opdagelse af kræftWenji Dong. Kredit:WSU Forskere fra Washington State University har udviklet en teknologi, der er mere end 30 gange mere følsom end nuværende laboratoriebaserede tests til at finde biomarkører for
- Hvad er en form for energikonversiton, der producerer en uønsket energi?
- Hvordan man opdager falsk indhold af kunstig intelligens – og hvad politikere kan gøre for at stopp…
- Nyt membranmateriale fjerner flere urenheder uden behov for giftige opløsningsmidler
- Hvilken energikonvertering finder sted i en solcelle?
- Hvad gør alle observationer og svar i videnskaben gyldige?
- Storstilet råvaredyrkning fremskynder klimaændringer i Amazonas


