Er siliciumdioxidopløselig i ikke -polær benzen?
* Polaritet: Siliciumdioxid er en meget polær forbindelse på grund af elektronegativitetsforskellen mellem silicium og ilt, hvilket resulterer i stærke ioniske bindinger. Benzen er på den anden side et ikke-polært molekyle.
* "som opløser som": Den generelle tommelfingerregel i kemi er, at "som opløser som." Polære stoffer har en tendens til at opløses i polære opløsningsmidler, mens ikke-polære stoffer opløses i ikke-polære opløsningsmidler.
* Intermolekylære kræfter: De stærke ioniske bindinger i siliciumdioxid er meget stærkere end de svage van der Waals -kræfter, der er til stede mellem benzenmolekyler. Disse forskelle i intermolekylære kræfter forhindrer signifikant interaktion mellem de to stoffer.
Derfor opløses siliciumdioxid ikke i benzen.
Sidste artikelHvad indeholder polære bindinger P4 H2S NO2 S22?
Næste artikelHvorfor er molekylet nitrogenpentachlorid umulig?
 Varme artikler
Varme artikler
-
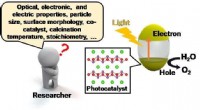 Fremskynder rejsen mod ren energi gennem fotokatalysatoroptimering(Højre) Skematisk af fotokatalytisk reaktion. (Venstre) Mange faktorer, der påvirker den fotokatalytiske ydeevne. Kredit:Osaka University Osaka University-forskere har studeret den fotokatalytiske
Fremskynder rejsen mod ren energi gennem fotokatalysatoroptimering(Højre) Skematisk af fotokatalytisk reaktion. (Venstre) Mange faktorer, der påvirker den fotokatalytiske ydeevne. Kredit:Osaka University Osaka University-forskere har studeret den fotokatalytiske -
 For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v
For en sand krig mod affald, modeindustrien skal bruge mere på forskningEn model bærer et af forfatterens originale zero waste designs. Stigningen af fast fashion i Australien betyder, at 6000 kg tøj bliver dumpet på lossepladsen hvert 10. minut. ABCs War On Waste v -
 Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø
Plastic upcycling:Fra affald til brændstof for mindrePlastaffald kan en dag blive upcyclet til brugbare råvarekemikalier i stedet for at ende i miljøet. Kredit:Cortland Johnson, Pacific Northwest National Laboratory En plastgenbrugsinnovation, der gø -
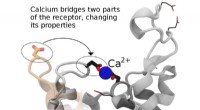 Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto,
Forstå en celles dørklokkeFremme af design af lægemidler til bedre medicinske effekter kræver en kombination af eksperimentel og computersimuleringsforskning. Forskere ved Los Alamos National Laboratory, University of Toronto,
- Simple Sudoku Instruktioner for Børn
- Pronominer betyder noget - brug af stedord formidler rummelighed
- Oversvømmelser påvirker mere end 1 million over hele Østafrika
- Når meget elektronegative atomer som iltbinding til med lavere elektronegativitet lithium, hvad er …
- ESAs nyeste teknologi CubeSat godkendt til lanceringssted
- Air France siger, at syv dages strejker koster virksomheden 170 millioner euro


