Når meget elektronegative atomer som iltbinding til med lavere elektronegativitet lithium, hvad er resultatet?
Her er hvorfor:
* Elektronegativitet: Oxygen har en meget højere elektronegativitet end lithium. Dette betyder, at ilt har et stærkere træk på de delte elektroner i bindingen.
* Elektronoverførsel: Den store elektronegativitetsforskel får ilt til i det væsentlige at "stjæle" elektronet fra lithium. Lithium mister sin valenselektron og bliver en positivt ladet ion (Li+). Oxygen vinder elektronet og bliver en negativt ladet ion (O2-).
* Elektrostatisk attraktion: De modsatte ladede ioner tiltrækkes derefter af hinanden gennem elektrostatiske kræfter og danner en stabil ionisk forbindelse.
Eksempel: Lithiumoxid (Li₂O) dannes, når lithium og ilt reagerer. Formlen afspejler afgiftene for ionerne:to lithiumioner (Li+) er nødvendige for at afbalancere ladningen for en oxidion (O2-).
Nøglepunkter:
* Ioniske bindinger er generelt stærke og involverer en komplet overførsel af elektroner.
* De resulterende forbindelser har høje smelte- og kogepunkter på grund af de stærke elektrostatiske kræfter mellem ionerne.
* Ioniske forbindelser er normalt opløselige i polære opløsningsmidler som vand.
Sidste artikelEr eddike den vandige opløsning af en syre?
Næste artikelHvordan adskiller vanddampen sig fra andre gasser, der udgør luft?
 Varme artikler
Varme artikler
-
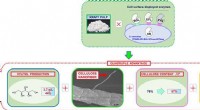 Fremstilling af xylitol og cellulose nanofibre af papirpasta – mod et grønt og bæredygtigt samfundFigur 1. Den firdobbelte fordel ved brug af modificeret gær Den økologiske bioproduktion af xylitol og cellulose nanofibre ved hjælp af modificerede gærceller, fra materiale produceret af papirind
Fremstilling af xylitol og cellulose nanofibre af papirpasta – mod et grønt og bæredygtigt samfundFigur 1. Den firdobbelte fordel ved brug af modificeret gær Den økologiske bioproduktion af xylitol og cellulose nanofibre ved hjælp af modificerede gærceller, fra materiale produceret af papirind -
 Kemikere lykkes med syntese af aminoalkoholer ved at udnytte lysFotosensibiliseret syntese af beskyttede aminoalkoholer. Kredit:WWU - Glorius Group Uanset om det er i betablokkere til behandling af forhøjet blodtryk eller i naturlige produkter, såkaldte vicina
Kemikere lykkes med syntese af aminoalkoholer ved at udnytte lysFotosensibiliseret syntese af beskyttede aminoalkoholer. Kredit:WWU - Glorius Group Uanset om det er i betablokkere til behandling af forhøjet blodtryk eller i naturlige produkter, såkaldte vicina -
 Blanding af silke med polymerer kan føre til bedre biomedicinske implantaterVed at kombinere silkestof med epoxy skabes laminater, der kan formes til former, ligesom strukturen ovenfor, til medicinsk brug. Kredit:Jiao Wen &Juan Guan Spundet af edderkopper og silkeorme, si
Blanding af silke med polymerer kan føre til bedre biomedicinske implantaterVed at kombinere silkestof med epoxy skabes laminater, der kan formes til former, ligesom strukturen ovenfor, til medicinsk brug. Kredit:Jiao Wen &Juan Guan Spundet af edderkopper og silkeorme, si -
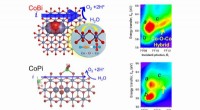 Forskere tager røntgenmål for at opdage ny brændstofkatalysatorDenne grafik viser de hybridorbitaler, hvor atomer kan dele elektroner i koboltboratkatalysatorer, hvilket gør det til en bedre vandspaltende katalysator end koboltphosphat. Kredit:Argonne National La
Forskere tager røntgenmål for at opdage ny brændstofkatalysatorDenne grafik viser de hybridorbitaler, hvor atomer kan dele elektroner i koboltboratkatalysatorer, hvilket gør det til en bedre vandspaltende katalysator end koboltphosphat. Kredit:Argonne National La
- Hvad er det indre overgangsmetal med lavest atomnummer?
- Astronauter ringer åbningsklokken for Nasdaq fra rumstationen
- Hvilken ting er mørk mere end nat?
- Hvilken type energi er statisk elektricitet?
- NASA opsender satellit for at udforske, hvor luft møder rummet
- Hvor lang tid tager hver planet for at bane solen?


