Hvor mange mol ammoniumioner er i 6,965 carbonat?
1. Bestem formlen for ammoniumcarbonat
Ammoniumcarbonat har formlen (NH₄) ₂co₃. Dette betyder, at det indeholder:
* To ammoniumioner (NH₄⁺)
* En carbonation (co₃²⁻)
2. Find den molære masse af ammoniumcarbonat
* N:14,01 g/mol * 2 =28,02 g/mol
* H:1,01 g/mol * 8 =8,08 g/mol
* C:12,01 g/mol * 1 =12,01 g/mol
* O:16,00 g/mol * 3 =48,00 g/mol
Total molær masse af (NH₄) ₂CO₃ =28.02 + 8.08 + 12.01 + 48.00 = 96.11 g/mol
3. Beregn molen af ammoniumcarbonat
Antag, at du har 6,965 g ammoniumcarbonat:
Moles =masse / molmasse
Mol =6,965 g/96,11 g/mol = 0,0725 mol (NH₄) ₂co₃
4. Bestem molen af ammoniumioner
Da hver mol ammoniumcarbonat indeholder to mol ammoniumioner:
Mol NH₄⁺ =0,0725 mol (NH₄) ₂CO₃ * 2 mol NH₄⁺ / 1 mol (NH₄) ₂CO₃ = 0,145 mol NH₄⁺
Derfor er der 0,145 mol ammoniumioner i 6,965 gram ammoniumcarbonat.
 Varme artikler
Varme artikler
-
 Materialeforskere viser måde at lave holdbare kunstige sener fra forbedrede hydrogelerMikroskopisk foto af det kunstige senemateriale udviklet af UCLA-materialeforskere. Forbedret til at bringe detaljer frem. Ægte skala af billedet er 1 cm i bredden. Kredit:Sidi Duan, Shuwang Wu, Mutia
Materialeforskere viser måde at lave holdbare kunstige sener fra forbedrede hydrogelerMikroskopisk foto af det kunstige senemateriale udviklet af UCLA-materialeforskere. Forbedret til at bringe detaljer frem. Ægte skala af billedet er 1 cm i bredden. Kredit:Sidi Duan, Shuwang Wu, Mutia -
 Ny sommerfugl-inspireret brintsensor drives af lysPh.d.-forsker Ebtsam Alenezy har en prototype af den lysaktiverede brintsensor, som kan levere ultrapræcise resultater ved stuetemperatur. Kredit:RMIT University Inspireret af overfladen af somm
Ny sommerfugl-inspireret brintsensor drives af lysPh.d.-forsker Ebtsam Alenezy har en prototype af den lysaktiverede brintsensor, som kan levere ultrapræcise resultater ved stuetemperatur. Kredit:RMIT University Inspireret af overfladen af somm -
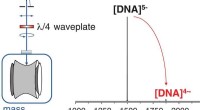 Brug af massespektrometri til at isolere guaninrige DNA-ionerEksperimentel opsætning til generering af cirkulært polariserede laserimpulser. Også vist er det typiske massespektrum efter isolering af D-[(dTGGGGT) 4 •(NH 4 + ) 3 ] 5– ioner og bestråling
Brug af massespektrometri til at isolere guaninrige DNA-ionerEksperimentel opsætning til generering af cirkulært polariserede laserimpulser. Også vist er det typiske massespektrum efter isolering af D-[(dTGGGGT) 4 •(NH 4 + ) 3 ] 5– ioner og bestråling -
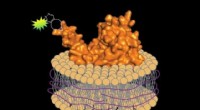 En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma
En platform til at forberede fluorescensmærkede proteiner og simulere deres native miljøVed at bruge en vaskemiddelfri metode, biologer kan fremstille fluorescens-mærkede proteiner sammen med et lille segment af den associerede cellemembran, bevare proteinets native miljø. Kredit:Jean-Ma
- Kan blandinger adskilles meget nemmere end forbindelser?
- Partikler fra maling, pesticider kan have dødelig virkning
- Sådan fungerer Dyson Spheres
- Efter at kvarts kalksten har omkrystalliseret, kaldes den nye rock?
- Hvorfor producerer damp masser af geotermisk energi?
- Hvorfor har forskellige væsker viscossiteter?


