Hvorfor opfører ammoniak ikke som en ideel gas?
1. Stærke intermolekylære kræfter: Ammoniakmolekyler har stærke hydrogenbindingsinteraktioner mellem dem. Disse kræfter er markant stærkere end de svage van der Waals -kræfter, der er til stede i ideelle gasser. Dette fører til afvigelser fra ideel gasadfærd, især ved lavere temperaturer og højere tryk, hvor molekylerne er tættere sammen, og de intermolekylære kræfter bliver mere dominerende.
2. Polaritet: Ammoniak er et polært molekyle på grund af tilstedeværelsen af et ensomt par elektroner på nitrogenatomet. Denne polaritet resulterer i dipol-dipolinteraktioner mellem molekyler, hvilket yderligere bidrager til afvigelser fra ideel opførsel.
3. Molekylær størrelse og form: Selvom den ikke er så signifikante som intermolekylære kræfter, kan den relativt lille størrelse og trigonale pyramidale form af ammoniakmolekyler også føre til afvigelser fra ideel gasopførsel. Molekylerne er ikke punktmasser, og deres endelige størrelse og form bidrager til kollisioner og interaktioner, der ikke er redegjort for i den ideelle gasmodel.
4. Kompressibilitet: Ammoniakmolekyler er komprimerbare, hvilket betyder, at deres volumen kan reduceres under tryk. Denne kompressibilitet redegøres ikke for i den ideelle gaslov, der antager, at gasser er ukomprimerbare.
5. Ægte gaseffekter: Ved høje tryk begynder ammoniakmolekyler at optage en betydelig del af containervolumenet, hvilket fører til afvigelser fra den ideelle gaslov, der antager, at gasmolekyler optager ubetydelig volumen.
Betingelser, hvor ammoniak opfører sig mere ideelt:
* Lavt tryk: Ved lavere tryk er molekylerne længere fra hinanden, hvilket reducerer påvirkningen af intermolekylære kræfter.
* Høj temperatur: Ved højere temperaturer har molekylerne mere kinetisk energi, hvilket overvinder de attraktive kræfter mellem dem.
Sammenfattende bidrager ammoniaks stærke intermolekylære kræfter, polaritet og molekylær størrelse og form alle til dens ikke-ideelle gasopførsel, især ved lavere temperaturer og højere tryk. Under visse betingelser, såsom lavt tryk og høj temperatur, kan ammoniak opføre sig mere som en ideel gas.
Sidste artikelHvilke mineraler er der i en printer?
Næste artikelHvor mange mol ammoniumioner er i 6,965 carbonat?
 Varme artikler
Varme artikler
-
 Molybdæntellurid nanoplader muliggør selektiv elektrokemisk produktion af hydrogenperoxid(a) SEM billede af MoTe2 nanoflakes. (b) (nederste panel) Polarisationskurver for MoTe2 -nanoflakes, bulk MoTe2 pulvere og grafen nanoark alene og (øverste panel) tilsvarende ringstrømme (streg linje)
Molybdæntellurid nanoplader muliggør selektiv elektrokemisk produktion af hydrogenperoxid(a) SEM billede af MoTe2 nanoflakes. (b) (nederste panel) Polarisationskurver for MoTe2 -nanoflakes, bulk MoTe2 pulvere og grafen nanoark alene og (øverste panel) tilsvarende ringstrømme (streg linje) -
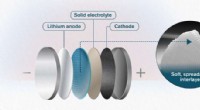 Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende
Et smørbart mellemlag kunne gøre solid state-batterier mere stabileSolid state-batterier er af stor interesse for elbilindustrien. Forskere ved Chalmers Tekniske Universitet, Sverige, og Xian Jiaotong University, Kina præsenterer nu en ny måde at bringe dette lovende -
 Nyt materiale baner vejen for fjernstyret medicin og elektroniske pillerPolymeroverfladen, der ses som børster på billedet, reagerer på en elektrisk puls ved at skifte tilstand fra at fange til at frigive de grønne biomolekyler. Polymeroverfladen fanger først biomolekyler
Nyt materiale baner vejen for fjernstyret medicin og elektroniske pillerPolymeroverfladen, der ses som børster på billedet, reagerer på en elektrisk puls ved at skifte tilstand fra at fange til at frigive de grønne biomolekyler. Polymeroverfladen fanger først biomolekyler -
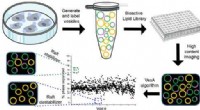 Biokemisk teknik til at finde små molekyler opdaget af forskereGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01058 Lipid-flåder, en komponent af plasmamembranerne, der omgiver alle celler i den menneskelige krop, er essentielle
Biokemisk teknik til at finde små molekyler opdaget af forskereGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01058 Lipid-flåder, en komponent af plasmamembranerne, der omgiver alle celler i den menneskelige krop, er essentielle
- Hvad er afstanden ækvator rejser på land?
- Afrikanske handelsskoler må ændre takt for at bekæmpe korruption
- Ny rekord kan indlede en ny æra for solenergi
- Kunstig intelligens afslører nye detaljer om gamle mestermalerier
- Californien kunne få 600, 000 acres af ny føderalt beskyttet vildmark
- Hvad kaldes de elektromagnetiske bølger med korteste bølgelængder og højeste frekvens kaldet?


