Hvad er de kemiske egenskaber ved gruppe 7 -elementer?
Kemiske egenskaber ved gruppe 7 -elementer (halogener):
Gruppe 7 -elementer, også kendt som halogener, deler adskillige forskellige kemiske egenskaber på grund af deres lignende elektroniske konfigurationer:
1. Meget reaktive ikke -metaller:
* Høj elektronegativitet: Halogener har en stærk tendens til at tiltrække elektroner på grund af deres høje elektronegativitet. Dette gør dem meget reaktive.
* Form Anions let: De får let en elektron til at danne negativt ladede ioner (halogenidioner) med en stabil ædelgaskonfiguration.
* reagerer med metaller for at danne ioniske forbindelser: Halogener reagerer let med metaller for at danne ioniske forbindelser, såsom NaCl (natriumchlorid) eller AgBr (sølvbromid).
2. Oxidation siger:
* mest almindelige oxidationstilstand: Halogener udviser typisk en -1 -oxidationstilstand i deres forbindelser.
* Andre oxidationstilstande: Fluor, det mest elektronegative element, findes kun i en -1 -oxidationstilstand. Imidlertid kan andre halogener udvise positive oxidationstilstande i forbindelser med flere elektronegative elementer som ilt.
3. Diatomisk natur:
* findes som diatomiske molekyler: Halogener findes som diatomiske molekyler (f.eks. Cl₂, br₂) i deres elementære form på grund af deres stærke tendens til at danne en kovalent binding med et andet atom af det samme element for at opnå stabilitet.
4. Reaktivitetstendenser:
* faldende reaktivitet ned i gruppen: Reaktivitet falder, når du bevæger dig ned ad gruppen fra fluor til jod. Dette skyldes, at atomstørrelse øges, og den yderste elektron er længere væk fra kernen, hvilket gør det mindre attraktivt for et andet atom.
* fluor er den mest reaktive: Fluor er den mest reaktive halogen på grund af dens lille størrelse, høje elektronegativitet og svag bindingsstyrke i F₂ -molekylet.
5. Farve og fysisk tilstand:
* Farve: Halogener udviser forskellige farver i deres elementære tilstand. F.eks. Er fluor lysegul, klor er grønlig-gul, brom er rødbrun væske, og jod er et mørkt lilla fast stof.
* Fysisk tilstand: Den fysiske tilstand af halogener ændrer gruppen fra gasser (F₂, CL₂) til væsker (Br₂) og faste stoffer (I₂).
6. Reaktioner med brint:
* Form brinthalogenider: Halogener reagerer med brint for at danne brinthalogenider (HF, HCI, HBR, HI), som er farveløse, sure gasser.
7. Reaktioner med ikke -metaller:
* Form kovalente forbindelser: Halogener reagerer med andre ikke -metaller for at danne kovalente forbindelser, ofte med flere oxidationstilstande.
8. Uforhold:
* halogener gennemgår uforholdsmæssig: Halogener kan gennemgå uforholdsmæssige reaktioner, hvor det samme element både oxideres og reduceres.
9. Anvendelser:
* Vigtigt i forskellige brancher: Halogener og deres forbindelser bruges i forskellige brancher, herunder farmaceutiske produkter, landbrug og plast.
* essentiel for menneskeliv: Halogener som klor er vigtige for vandrensning og desinfektion, mens jod er afgørende for produktion af skjoldbruskkirtelhormon.
Dette er nogle af de vigtigste kemiske egenskaber ved gruppe 7 -elementer (halogener). At forstå disse egenskaber er afgørende for at forudsige deres reaktivitet og forstå deres forskellige applikationer.
Sidste artikelHvilket mineral er fladt med flassende spaltning?
Næste artikelIs -kilning er en form for kemisk forvitring.?
 Varme artikler
Varme artikler
-
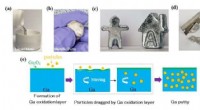 Spartellignende kompositter af galliummetal med potentiale til anvendelse i virkeligheden(a) Flydende gallium hældes i en beholder. (b) Galliumkitt støbes til en kugle. (c) Forskellige figurer fremstillet af galliumspartel. (d) Galliumspartel skæres af et blad. (e) Mekanismen for dannelse
Spartellignende kompositter af galliummetal med potentiale til anvendelse i virkeligheden(a) Flydende gallium hældes i en beholder. (b) Galliumkitt støbes til en kugle. (c) Forskellige figurer fremstillet af galliumspartel. (d) Galliumspartel skæres af et blad. (e) Mekanismen for dannelse -
 Forskere får første kig på geometrisk faseeffekt i en kemisk reaktionSkematisk illustration af den geometriske faseeffekt, der opstår i H+HD-reaktionen:den forskellige interferens af to reaktionsveje. Kredit:SUN Zhigang I den simpleste kemiske reaktion i naturen, d
Forskere får første kig på geometrisk faseeffekt i en kemisk reaktionSkematisk illustration af den geometriske faseeffekt, der opstår i H+HD-reaktionen:den forskellige interferens af to reaktionsveje. Kredit:SUN Zhigang I den simpleste kemiske reaktion i naturen, d -
 Naturafledte peptider som molekylære værktøjer til at studere cellulær signaleringKredit:Medical University of Vienna En gruppe forskere fra Institute of Pharmacology ved Medical University of Vienna i samarbejde med University of Vienna og forskellige institutioner i Australie
Naturafledte peptider som molekylære værktøjer til at studere cellulær signaleringKredit:Medical University of Vienna En gruppe forskere fra Institute of Pharmacology ved Medical University of Vienna i samarbejde med University of Vienna og forskellige institutioner i Australie -
 Hvad gør den dødbringende pufferfish så lifligForskere har identificeret de vigtigste forbindelser, der er ansvarlige for smagen af pufferfish ( Takifugu obscurus ). Kredit:Yuan Liu Nogle mennesker overvejer pufferfish, også kendt som fug
Hvad gør den dødbringende pufferfish så lifligForskere har identificeret de vigtigste forbindelser, der er ansvarlige for smagen af pufferfish ( Takifugu obscurus ). Kredit:Yuan Liu Nogle mennesker overvejer pufferfish, også kendt som fug
- En 18 kg cykel, der bærer en 62 pige, rejser med en hastighed på 7 ms, hvilken kinetisk energi?
- Dataassimilering forbedrer prognoserne for aerosol- og gasformige forurenende stoffer markant i hele…
- Er alle ioniske forbindelser inkluderer mindst to elementer sandt?
- Underskrifter kan ændres for at afbalancere en kemisk ligning.?
- Hvilket molekyle bruger en proteinpumpe til energi?
- Undersøgelsen afslører almindelige vaner og færdigheder blandt meget produktive ledere


