Er benzen et kovalent fast stof eller molekylært fast stof?
* kovalente faste stoffer dannes af et netværk af kovalent bundet atomer, der strækker sig over hele faste stoffer. Eksempler inkluderer diamant- og siliciumdioxid.
* molekylære faste stoffer dannes af molekyler holdt sammen af svagere intermolekylære kræfter (som van der Waals-kræfter, dipol-dipolinteraktioner eller hydrogenbinding).
Benzen er sammensat af individuelle benzenmolekyler, der holdes sammen af van der Waals -styrker. Disse kræfter er svagere end de kovalente bindinger inden for hvert benzenmolekyle. Dette betyder, at benzen har et relativt lavt smeltepunkt og kogepunkt, der er karakteristisk for molekylære faste stoffer.
 Varme artikler
Varme artikler
-
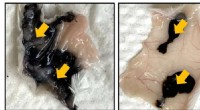 En forbedret blæk til kolontatoveringerEt kommercielt blæk (venstre) diffunderer langt fra injektionssteder (pile) under musens hud, men et nyt kolontatoveringsblæk (højre) diffunderer meget mindre. Kredit:Jordan Yaron, Ph.D. Tyktarmen
En forbedret blæk til kolontatoveringerEt kommercielt blæk (venstre) diffunderer langt fra injektionssteder (pile) under musens hud, men et nyt kolontatoveringsblæk (højre) diffunderer meget mindre. Kredit:Jordan Yaron, Ph.D. Tyktarmen -
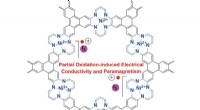 Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In
Nye 2-D metal organiske rammer med interessant elektrisk ledningsevne og magnetiske egenskaberFigur 1. Kemisk struktur af jod-dopet Ni (II) tetraaza [14] annulenbundet MOF (NiTAA-MOF). Mens NiTAA-MOF er en isolator, det oxiderede molekyle får elektrisk ledningsevne og paramagnetisme. Kredit:In -
 Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning
Fra kompost til kompositter:En miljøvenlig måde at forbedre gummi påKredit:American Chemical Society Begrebet fra skrald til skat gælder for komposteringens verden, hvor madaffald genanvendes til gødning til haver. Men hvad nu hvis kompost kunne gå ud over gødning -
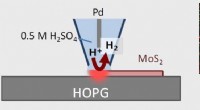 Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers
Billedbehandlingsteknik giver katalytisk 2-D materialeteknik et bedre udsynScanning elektrokemisk cellemikroskopi (SECCM) muliggør billeddannelse og kvantitativ analyse af hydrogenudviklingsreaktion (HER) katalytisk aktive steder i 1H MoS 2 monolag. Kredit:Kanazawa Univers
- Undersøgelse siger, at havene kan stige hurtigere end antaget
- Hvordan selvkørende biler vil gøre vores byer mere charmerende
- Er en Galaxy større end Nebula?
- Ny forskning viser, hvordan COVID-19 ændrede amerikanernes intentioner om at flytte
- Hvilken butik sælger GPS -håndholdte systemer?
- Hvordan opnås nitrogen og brint?


