Hvordan reagerer gruppe 7 -elementer med ilt?
Her er en sammenbrud:
fluor (F):
* Fluor er den mest reaktive halogen og reagerer let med ilt, selv ved stuetemperatur.
* Det danner iltdifluorid (of2) , en farveløs gas med en skarp lugt.
* Det kan også danne dioxygen difluorid (O2F2) , et gult fast stof under specifikke forhold.
klor (CL):
* Klor reagerer med ilt til dannelse af dichlormonoxid (CL2O) , en gulbrun gas.
* Andre oxider som klordioxid (CLO2) , en gulgrøn gas og chlorheptoxid (CL2O7) , en farveløs væske, er også kendt.
brom (Br):
* Brom reagerer med ilt til dannelse af brommonoxid (BR2O) , et brunt fast stof.
* Andre oxider som bromdioxid (bro2) , et gult fast stof og brom trioxid (bro3) , en farveløs gas, er også kendt.
jod (i):
* Jod reagerer med ilt til dannelse af jodmonoxid (I2O) , et gult fast stof.
* Andre oxider som joddioxid (IO2) , et hvidt fast stof og jodpentoxid (I2O5) , et hvidt fast stof, er også kendt.
astatine (at):
* Astatine er et radioaktivt element, og dets oxider er dårligt karakteriseret på grund af dets korte halveringstid.
Generelle observationer:
* Halogenernes reaktivitet med ilt falder ned i gruppen. Dette skyldes, at elektronegativiteten af halogenerne falder ned i gruppen, hvilket gør det sværere for dem at tiltrække iltatomer.
* Oxiderne af halogener er generelt ustabile og kan være eksplosive.
* Oxiderne af halogener kan fungere som oxidationsmidler.
Bemærk: Dette er blot nogle af de mere almindelige oxider, der er dannet. Der er andre, mindre almindelige, oxider af halogener kendt, men de diskuteres ikke her.
 Varme artikler
Varme artikler
-
 Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno
Analyse af fordele og ulemper ved to sammensatte fremstillingsmetoderKredit:Pixabay/CC0 Public Domain Flyvinger, vindmøllevinger, og andre store dele er typisk fremstillet ved hjælp af bulkpolymerisation i kompositproduktionsfaciliteter. De opvarmes og hærdes i eno -
 Kemikere udvikler rammer for at muliggøre effektiv syntese af informationstætte molekylerKredit:ACS Et team ledet af forskere ved Scripps Research har udviklet en teoretisk tilgang, der kan lette processen med at gøre meget kompleks, kompakte molekyler. Sådanne molekyler findes ofte
Kemikere udvikler rammer for at muliggøre effektiv syntese af informationstætte molekylerKredit:ACS Et team ledet af forskere ved Scripps Research har udviklet en teoretisk tilgang, der kan lette processen med at gøre meget kompleks, kompakte molekyler. Sådanne molekyler findes ofte -
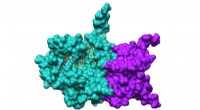 Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a
Forskere bruger Theta til analyse i realtid af COVID-19 proteinerNsp10/16 overflade med ligander. Forskere har udviklet en pipeline til at forbinde ALCF-supercomputere med APS-eksperimenter for at muliggøre analyse i realtid af COVID-19-proteiner, baner vejen for a -
 Kemikere skaber en ny vej til PHA'er:naturligt nedbrydeligt bioplastFra venstre:kandidatstuderende Andrea Westlie, professor Eugene Chen, og forsker Xiaoyan Tang i Chemistry Research Building. Kredit:John Eisele En bølge af offentlig fremdrift svulmer op mod krise
Kemikere skaber en ny vej til PHA'er:naturligt nedbrydeligt bioplastFra venstre:kandidatstuderende Andrea Westlie, professor Eugene Chen, og forsker Xiaoyan Tang i Chemistry Research Building. Kredit:John Eisele En bølge af offentlig fremdrift svulmer op mod krise
- Tror du, at al din plastik bliver genbrugt? Ny forskning viser, at den kan ende i havet
- Speciel algoritme til Twitter kan afsløre flypassagerernes tilfredshed
- Et nyt britisk astronomiinstrument er indstillet til Mexico
- Hvad er de 5 processer, der er involveret i stofskifte?
- 2 måder RNA er som DNA?
- Gummi arabicum fra Afrikas akacietræer i Sahel bruges i hundredvis af produkter:Hvad er værd at vi…


