Bliver løsningen af thiosulfatreaktion overskyet?
reaktioner, der kan føre til en overskyet løsning:
* reaktion med stærke syrer: Thiosulfationer reagerer med stærke syrer som saltsyre (HCI) for at producere svovldioxid (SO₂), svovl (er) og vand (H₂O). Det producerede svovl er uopløseligt i vand og danner et mælkehvid bundfald, hvilket gør opløsningen overskyet.
* reaktion med jod: Thiosulfationer reagerer med jod (i₂) for at danne iodidioner (I⁻) og tetrathionationer (s₄o₆²⁻). Imidlertid anvendes denne reaktion ofte i iodometri -titrationer, hvor jodopløsningen tilsættes til en thiosulfatopløsning. En overskyet opløsning kan forekomme, hvis koncentrationen af jod er for høj, hvilket fører til et overskud af jod og dannelsen af et bundfald af jod.
* reaktion med visse metalioner: Thiosulfationer kan reagere med nogle metalioner (f.eks. Sølv, bly) til dannelse af uopløselige sulfider, hvilket kan gøre opløsningen overskyet.
reaktioner, der normalt ikke fører til en overskyet løsning:
* reaktion med natriumhydroxid: Thiosulfationer reagerer med natriumhydroxid (NaOH) for at danne natriumthiosulfat (na₂s₂o₃) og vand (H₂O). Denne reaktion producerer ikke noget bundfald, så opløsningen forbliver klar.
Vigtige noter:
* Klarheden i opløsningen afhænger af de specifikke reaktionsbetingelser, herunder koncentrationerne af reaktanter, temperatur og tilstedeværelse af andre stoffer.
* En overskyet løsning er ikke altid en indikation af en kemisk reaktion. Det kan skyldes urenheder eller andre faktorer.
for at vide med sikkerhed, om en bestemt reaktion bliver overskyet, skal du overveje den specifikke kemiske reaktion og dens produkter.
 Varme artikler
Varme artikler
-
 Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at
Brug af en porøs porphyrin til at genvinde ædle metaller fra elektronisk affaldPorøs porfyrinpolymer (COP-180) kan udvinde guld fra et computerkredsløb og producere rene guldklumper. Kredit:Yeongran Hong Et internationalt hold af forskere har brugt en porøs porphyrin til at -
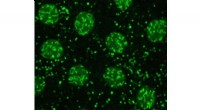 Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min
Lipiddråber spiller afgørende roller ud over fedtopbevaringForskerne brugte avanceret fluorescensmikroskopi til at se lipiddråber i frugtflueembryoner. Her, H2Av (fluoresceret i grønt) er til stede i cellens kerner (de store klatter) og på lipiddråber (de min -
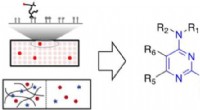 Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr
Bestemmelse af, hvad der binder til slimKredit:American Chemical Society Menneskekroppen er fuld af slim. Denne tyktflydende goo er ikke bare en gene, der bliver hostet eller nyset ud - det kan binde sig til medicin, toksiner eller mikr -
 Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to
Ingeniører tester medicinoverførsel ved hjælp af placenta-på-en-chipHuh-laboratoriets placenta-på-en-chip har to mikrofluidiske kanaler, der repræsenterer moderens og føtale kredsløbssystemer, og en membran med levende celler fra placentabarrieren, der adskiller de to
- The Renewable snarere end Roaring Twenties:Et bæredygtighedsårti
- Slam:Hvordan virksomheder tvinger os til at bruge mere
- Hvad er lydhastigheden ved nul grader celsius?
- Lys afsporer elektroner gennem grafen
- Holografisk histopatologi muliggør hurtig, præcis diagnostik
- Når en videnskabsmand fremsætter et uddannet gæt om, hvad det rigtige svar på videnskabseksperim…


