Hydrogenbinding i vandårsager til?
* højt kogepunkt og smeltepunkt: De stærke hydrogenbindinger mellem vandmolekyler kræver en betydelig mængde energi til at bryde, hvilket fører til et højere kogepunkt og smeltepunkt end forventet for et molekyle af dens størrelse.
* Høj overfladespænding: Den stærke tiltrækning mellem vandmolekyler på grund af hydrogenbinding giver vand en høj overfladespænding, hvilket gør det muligt for det at danne dråber og modstå eksterne kræfter.
* Høj varmekapacitet: Vand kan absorbere en stor mængde varmeenergi uden en signifikant stigning i temperaturen på grund af brintbindingerne. Dette gør vand til et fremragende kølevæske og hjælper med at regulere Jordens klima.
* universelt opløsningsmiddel: Vands polaritet og evne til at danne brintbindinger gør det til et fremragende opløsningsmiddel for mange stoffer, herunder salte, sukker og proteiner. Dette er afgørende for livet, som vi kender det.
* Usædvanlig densitetsadfærd: Vand er mest tæt ved 4 ° C. Dette skyldes hydrogenbindingerne, der får vandmolekyler til at arrangere i en krystallinsk struktur ved lave temperaturer, hvilket gør det mindre tæt end flydende vand. Denne egenskab er vigtig for akvatisk liv, da den giver is mulighed for at flyde og isolere vand nedenfor.
Sammenfattende er hydrogenbinding i vand ansvarlig for mange af dets unikke og essentielle egenskaber, der er afgørende for livet på jorden.
Sidste artikelHvad sker der, når et metal oxideres?
Næste artikelKemisk formel for carbon IV -oxid?
 Varme artikler
Varme artikler
-
 Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote
Forskere rapporterer kraftig ionoverførsel i ladet vdW-klynge for første gangSammenfaldskortet viser tidspunktet for flyvninger mellem det første og det andet fragmention, der ankommer til detektoren. Kredit:IMP Siden opdagelsen af den dobbelte helixform af DNA og hypote -
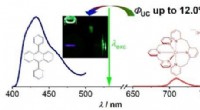 En ny vej til bæredygtig fotonopkonvertering med ikke-ædelmetallerDen molekylære rubin [Cr(bpmp)2 ]3+ med en jordrig chrom(III) central ion sensibiliserer grøn-til-blå triplet-triplet annihilation opkonvertering med 9,10-diphenylanthracen som annihilator. Processen
En ny vej til bæredygtig fotonopkonvertering med ikke-ædelmetallerDen molekylære rubin [Cr(bpmp)2 ]3+ med en jordrig chrom(III) central ion sensibiliserer grøn-til-blå triplet-triplet annihilation opkonvertering med 9,10-diphenylanthracen som annihilator. Processen -
 Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert
Video:Kan vi gøre opioider mindre vanedannende?Kredit:The American Chemical Society Opioider er de mest kraftfulde smertestillende midler, vi har, men de er utroligt vanedannende. Titusindvis af mennesker i USA dør af en opioidoverdosis hvert -
 Knækker koden til soddannelse - forskere låser op for mysterium for at hjælpe med at reducere far…Forskere har opdaget en mekanisme til soddannelse, løse et mangeårigt videnskabeligt mysterium. På dette billede af en stearinlysflamme, farverne er fra varm sodluminescens. Massespektret i bunden vis
Knækker koden til soddannelse - forskere låser op for mysterium for at hjælpe med at reducere far…Forskere har opdaget en mekanisme til soddannelse, løse et mangeårigt videnskabeligt mysterium. På dette billede af en stearinlysflamme, farverne er fra varm sodluminescens. Massespektret i bunden vis
- Hvad er tre måder, hvorpå en bilhastighed vil ændre sig?
- Forskere viser, at neutrinoer ikke kun kan levere fuld-on hits, men også 'glitende slag'
- Hvad er den kemiske sammensætning af maling?
- Smartphones kan forbedre den akademiske præstation, når det bruges rigtigt
- Hvordan dannes bioklastisk bjergart?
- The geoengineering of consent:Hvordan konspiratister dominerer YouTubes klimavidenskabelige indhold


