Hvorfor er ionc -forbindelser stærkere end kovalente forbindelser?
ioniske forbindelser:
* stærkere elektrostatiske attraktioner: Ioniske forbindelser dannes af den elektrostatiske tiltrækning mellem modsat ladede ioner. Disse kræfter er meget stærke, hvilket fører til høje smelte- og kogepunkter.
* hårdt og sprødt: Den stive struktur af ioniske gitter gør dem hårde. Imidlertid gør de stærke elektrostatiske kræfter dem også sprøde, da et lille skift i gitteret kan forstyrre hele strukturen.
* Opfør elektricitet i smeltede eller vandige opløsninger: Ioniske forbindelser udfører kun elektricitet, når ionerne er frie til at bevæge sig, såsom i en smeltet tilstand eller når de opløses i vand.
* generelt opløselig i polære opløsningsmidler: Ioniske forbindelser er typisk opløselige i polære opløsningsmidler som vand, fordi de polære opløsningsmiddelmolekyler kan interagere med de ladede ioner og trække dem fra hinanden.
kovalente forbindelser:
* stærke kovalente obligationer: Kovalente bindinger involverer deling af elektroner mellem atomer. Disse obligationer kan være meget stærke, især i dobbelt- og tredobbelt obligationer.
* Varierede smeltnings- og kogepunkter: Smeltnings- og kogepunkterne for kovalente forbindelser varierer meget afhængigt af styrken af de kovalente bindinger og tilstedeværelsen af intermolekylære kræfter.
* generelt ikke ledende: De fleste kovalente forbindelser udfører ikke elektricitet, fordi de ikke har frit bevægende ladede partikler.
* opløselig i ikke -polære opløsningsmidler: Kovalente forbindelser har en tendens til at være opløselige i ikke -polære opløsningsmidler, fordi de kan interagere med lignende ikke -polære molekyler.
så, som er stærkere?
* styrke med hensyn til obligationer: Kovalente obligationer kan være utroligt stærke, især når flere obligationer er involveret.
* styrke med hensyn til smeltning og kogepunkter: Ioniske forbindelser har generelt højere smelte- og kogepunkter på grund af de stærke elektrostatiske attraktioner.
* styrke med hensyn til fysiske egenskaber: Ioniske forbindelser er typisk hårdere og mere sprøde, mens kovalente forbindelser kan udvise en bredere række fysiske egenskaber afhængigt af deres struktur.
Konklusion:
Det er mere nøjagtigt at sige, at ioniske og kovalente forbindelser har forskellige styrker og svagheder afhængigt af konteksten. Begge typer forbindelser spiller vigtige roller inden for kemi og biologi.
 Varme artikler
Varme artikler
-
 Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs
Bæredygtig, stærkt selektiv biokatalytisk omdannelse af aldehyder til carboxylsyrerForsidebillede af den aktuelle udgave af Green Chemistry med HIMS/Biocat -forskningen. Forskere fra University of Amsterdams Vant Hoff Institute for Molecular Sciences (HIMS) har udviklet den førs -
 Vandbehandling - ny metode eliminerer hormonerMetoden udviklet af KIT kombinerer fordelene ved at binde mikroforurenende stoffer med aktivt kul med fordelene ved ultrafiltrering. Kredit:Sandra Göttisheim, SÆT Hormoner og andre mikroforurenend
Vandbehandling - ny metode eliminerer hormonerMetoden udviklet af KIT kombinerer fordelene ved at binde mikroforurenende stoffer med aktivt kul med fordelene ved ultrafiltrering. Kredit:Sandra Göttisheim, SÆT Hormoner og andre mikroforurenend -
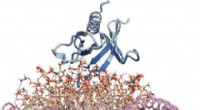 Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove
Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove -
 Hvor godt match er det? Lægger statistik ind i retsmedicinsk skydevåbenidentifikationWilmer Souder, en fysiker og tidlig retsmediciner ved National Bureau of Standards, nu NIST, sammenligner to kugler ved hjælp af et sammenligningsmikroskop. Souder lærte retsmedicinske teknikker af Ca
Hvor godt match er det? Lægger statistik ind i retsmedicinsk skydevåbenidentifikationWilmer Souder, en fysiker og tidlig retsmediciner ved National Bureau of Standards, nu NIST, sammenligner to kugler ved hjælp af et sammenligningsmikroskop. Souder lærte retsmedicinske teknikker af Ca
- Trump beder NASA om at sende amerikanere til Månen
- Hvilket mineral er integreret i paleomagnetisme?
- Hvordan at ændre verdens fødevaresystemer kan hjælpe med at beskytte planeten
- Forskere udvikler en lille sensor til at måle subtile trykændringer inde i kroppen
- Ingeniørforskere studerer nanostrukturer fra principper til applikationer
- Afrikansk ubuntu kan uddybe, hvordan forskning udføres


