Hvilken masse H2O produceres, når 12,0 gram HCl reagerer fuldstændigt i ligningen 6HCl Fe2O32Fecl3 3H2O?
1. Balance ligningen:
Ligningen, du leverede, er allerede afbalanceret:
6HCl + Fe₂o₃ → 2Fecl₃ + 3H₂O
2. Beregn den molære masse af HCL og H₂O:
* HCI:1,01 g/mol (H) + 35,45 g/mol (Cl) =36,46 g/mol
* H₂O:2,02 g/mol (H) + 16,00 g/mol (O) =18,02 g/mol
3. Konverter gram HCL til mol:
* Mol HCl =(12,0 g HCI) / (36,46 g / mol HCI) =0,329 mol HCI
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser et forhold på 6:3 mol mellem HCI og H₂O. Dette betyder for hver 6 mol HCI, der produceres 3 mol H₂O.
5. Beregn molen af produceret H₂O:
* Mol H₂O =(0,329 mol HCI) * (3 mol H₂O / 6 mol HCI) =0,165 mol H₂O
6. Konverter mol H₂O til gram:
* Gram H₂O =(0,165 mol H₂O) * (18,02 g/mol H₂O) =2,97 g H₂O
Derfor produceres 2,97 gram H₂O, når 12,0 gram HCL reagerer fuldstændigt.
Sidste artikelHvad er den fysiske egenskabsanvendelse af sammensat natriumhydroxid?
Næste artikelEr klorgas en homogen blanding?
 Varme artikler
Varme artikler
-
 In vivo-lægemiddelopdagelse til at øge inkretin-udtrykkende celler i diabetesGrafisk abstrakt. Kredit:Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.08.001 En ny undersøgelse offentliggjort i Cell Chemical Biology beskriver en alternativ tilgang til behandling af
In vivo-lægemiddelopdagelse til at øge inkretin-udtrykkende celler i diabetesGrafisk abstrakt. Kredit:Cell Chemical Biology (2022). DOI:10.1016/j.chembiol.2022.08.001 En ny undersøgelse offentliggjort i Cell Chemical Biology beskriver en alternativ tilgang til behandling af -
 Blandeløsninger i verdens mindste reagensglasKredit:University of Manchester Forskere baseret på University of Manchester har demonstreret en ny metode til billeddannelse af levende kemiske reaktioner med atomopløsning ved hjælp af reagensgl
Blandeløsninger i verdens mindste reagensglasKredit:University of Manchester Forskere baseret på University of Manchester har demonstreret en ny metode til billeddannelse af levende kemiske reaktioner med atomopløsning ved hjælp af reagensgl -
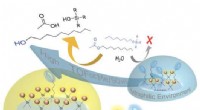 Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me
Nøglebeviser, der forbinder hydrofobicitet med effektiv syrekatalyseForenklet skematisk, der viser, hvordan alkylacetater med lange haler ikke kan nærme sig sure sulfo-steder (blå skiver) i hydrofile miljøer; imidlertid, de kan nærme sig hydrofobe miljøer med flere me -
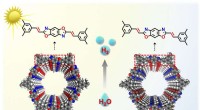 Nye isomere vinylen-bundne kovalente organiske rammer udviklet med distinkte fotokatalytiske egenska…De isomere vinylen-bundne kovalente organiske rammer. Kredit:NIMTE Forskere ledet af prof. Zahng Tao ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskab
Nye isomere vinylen-bundne kovalente organiske rammer udviklet med distinkte fotokatalytiske egenska…De isomere vinylen-bundne kovalente organiske rammer. Kredit:NIMTE Forskere ledet af prof. Zahng Tao ved Ningbo Institute of Materials Technology and Engineering (NIMTE) fra det kinesiske videnskab
- Er et brændende lyspotentiale eller kenetisk energi?
- Genskabelse af spøgelseskvarterer ødelagt af motorveje
- Materiale er sammensat af små partikler, der er i konstant bevægelse, hvad de?
- Sådan fungerer haglgeværer
- Eksperiment viser, hvordan ormeværter og tilhørende mikrobiom i fællesskab bidrager til miljøtil…
- Trivsel for efterladte børn i Kirgisistan fokus for undersøgelse


