Hvis volumenet af en fast mængde gas ved konstant temperatur mindsker det tryk, gør det, hvad?
Dette skyldes Boyle's Law , der siger, at trykket fra en gas er omvendt proportionalt med dens volumen ved en konstant temperatur.
Her er hvorfor:
* Flere kollisioner: Når volumenet falder, er gasmolekylerne begrænset til et mindre rum. Dette betyder, at de kolliderer med murene i beholderen oftere.
* øget kraft: De øgede kollisioner fører til en højere kraft, der udøves på beholderens vægge.
* Højere pres: Tryk er defineret som kraft pr. Enhedsareal. Da kraften øges med de hyppigere kollisioner, øges presset også.
I matematiske termer kan Boyle's lov udtrykkes som:
p₁v₁ =p₂v₂
hvor:
* P₁ =oprindeligt tryk
* V₁ =indledende bind
* P₂ =endelig pres
* V₂ =slutvolumen
Så hvis volumenet falder (v₂
Sidste artikelHvad er den kemiske formel for calciumethanoat?
Næste artikelEr P4 et elementforbindelse eller molekyle?
 Varme artikler
Varme artikler
-
 Forskere finder en miljøvenlig måde at farve blå jeans påProcessen med at farve jeans er en af de største kilder til forurening inden for modeindustrien. Ny forskning fandt et mere miljøvenligt alternativ. Kredit:Andrew Davis Tucker/UGA Blusset eller
Forskere finder en miljøvenlig måde at farve blå jeans påProcessen med at farve jeans er en af de største kilder til forurening inden for modeindustrien. Ny forskning fandt et mere miljøvenligt alternativ. Kredit:Andrew Davis Tucker/UGA Blusset eller -
 Maskinlæring sætter ind i katalysatorinteraktioner for at fremskynde materialeudviklingKredit:CC0 Public Domain En maskinlæringsteknik genopdagede hurtigt reglerne for katalysatorer, som det tog mennesker år med vanskelige beregninger at afsløre - og endda forklarede en afvigelse. U
Maskinlæring sætter ind i katalysatorinteraktioner for at fremskynde materialeudviklingKredit:CC0 Public Domain En maskinlæringsteknik genopdagede hurtigt reglerne for katalysatorer, som det tog mennesker år med vanskelige beregninger at afsløre - og endda forklarede en afvigelse. U -
 Går småt for at bestemme, hvor nukleart materiale kom fra, og hvordan det blev lavetIn-situ uran-isotop-billeddannelse af NanoSIMS kan give indsigt i proceshistorien og oprindelsen af materialer til nukleare brændstofpellets til støtte for nuklear retsmedicinske undersøgelser. Kred
Går småt for at bestemme, hvor nukleart materiale kom fra, og hvordan det blev lavetIn-situ uran-isotop-billeddannelse af NanoSIMS kan give indsigt i proceshistorien og oprindelsen af materialer til nukleare brændstofpellets til støtte for nuklear retsmedicinske undersøgelser. Kred -
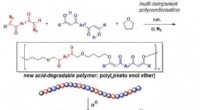 Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde
Ny syntetisk polymer nedbrydeligt under meget milde sure betingelserFremstilling af ny nedbrydelig syntetisk polymer. Kredit:Ehime University Et forskerhold ved Ehime University forberedte en ny type syntetisk polymer, som kan nedbrydes til en kombination af velde
- Hvad kan beskrive bevægelsen af et objekt?
- Far bod FTW, amirite? Ordbog tilføjer hundredvis af nye ord
- Hvad er det højeste bjerg på Isle of Skye?
- WAT SALT er ansvarlig for midlertidig og permanent hårdhed af vand?
- Hvad er resultatet af afbøjede ladede partikler langs Van Allen -bælter?
- Hvor går ungdomsgenaktiviteten hen? Nye fund kan holde nøglen


