Hvilken masse fast AgCl opnås, når 25 ml 0,068 M AGNO3 reagerer med overskydende vandig HCL?
1. Skriv den afbalancerede kemiske ligning:
Agno₃ (aq) + HCL (aq) → Agcl (s) + hno₃ (aq)
2. Bestem molen af Agno₃:
* Molaritet (M) =mol (mol) / volumen (L)
* 0,068 m =mol / 0,025 l
* mol Agno₃ =0,0017 mol
3. Brug molforholdet fra den afbalancerede ligning til at finde mol af AGCL:
* Den afbalancerede ligning viser et forhold på 1:1 mol mellem Agno₃ og AgCl. Derfor vil 0,0017 mol Agno₃ producere 0,0017 mol AGCl.
4. Beregn massen af AGCL:
* Molmasse AgCl =143,32 g/mol
* masse =mol x molmasse
* Masse AgCl =0,0017 mol x 143,32 g/mol
* masse AGCL =0,244 g
Derfor opnås 0,244 g fast AGCL.
 Varme artikler
Varme artikler
-
 Undersøgelse ser til is for at fremstille nyttige porøse materialerXiao Cheng Zeng (til venstre) og Chonqin Zhou. Kredit:University of Nebraska-Lincoln At opdage en måde at udnytte isrekrystallisering på kunne muliggøre fremstilling af højeffektive materialer til
Undersøgelse ser til is for at fremstille nyttige porøse materialerXiao Cheng Zeng (til venstre) og Chonqin Zhou. Kredit:University of Nebraska-Lincoln At opdage en måde at udnytte isrekrystallisering på kunne muliggøre fremstilling af højeffektive materialer til -
 Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h
Open source-software behandler hurtigt spektrale data, identificerer og kvantificerer lipidarter nø…LIQUID-grænsefladen. Kredit:Pacific Northwest National Laboratory Lipider spiller en nøglerolle i mange stofskiftesygdomme, herunder hypertension, diabetes, og slagtilfælde. Så det er vigtigt at h -
 Teams billede af revner i handlingen kunne forhindre tekniske fejlAvanceret billeddannelse giver spor til at forudsige brud i metaller. I dette studie, revner i en nikkellegering, der blev sprød af brint, blev fanget rødhændede, da de forplantede sig langs korngræns
Teams billede af revner i handlingen kunne forhindre tekniske fejlAvanceret billeddannelse giver spor til at forudsige brud i metaller. I dette studie, revner i en nikkellegering, der blev sprød af brint, blev fanget rødhændede, da de forplantede sig langs korngræns -
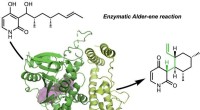 Forskere opdager de første enzymer til at katalysere en klassisk organisk reaktionKredit:University of California, Los Angeles The Tang, Garg, og Houk-forskningsgrupper har opdaget naturens naturlige proteinkatalysatorer (enzymer), der katalyserer Alder-en-reaktionen. Alle gru
Forskere opdager de første enzymer til at katalysere en klassisk organisk reaktionKredit:University of California, Los Angeles The Tang, Garg, og Houk-forskningsgrupper har opdaget naturens naturlige proteinkatalysatorer (enzymer), der katalyserer Alder-en-reaktionen. Alle gru
- Kemikere designer hurtigere produktionsproces for essentielle sukkerarter
- Hvorfor er det vigtigt at beskytte computerudstyr mod statisk ladning?
- Hvor mange mol HCI kan 0,055 g calciumcarbonatneutralisering?
- Hvad kalder de vulkan dannet af Liquid Rock?
- Hvor gammel er Jorden i forhold til universets alder?
- General Motors investerer $22M mere i Tennessee-anlægget


