Hvad er den empiriske formel for en carbonhydrid, der indeholder 85,7 procent kulstof og 14,3 brint?
1. Antag en 100-gram prøve:
* Dette gør beregningerne lettere, da procenterne direkte oversættes til gram.
* 85,7 gram kulstof (c)
* 14.3 gram brint (H)
2. Konverter gram til mol:
* Opdel hvert elements masse med dets molære masse:
* Kulstof:85,7 g / 12,01 g / mol =7,14 mol
* Hydrogen:14,3 g / 1,01 g / mol =14,16 mol
3. Find det enkleste forhold mellem hele tal:
* Opdel hver molværdi med den mindste molværdi (7,14 mol i dette tilfælde):
* Carbon:7,14 mol / 7,14 mol =1
* Hydrogen:14,16 mol / 7,14 mol =2
4. Skriv den empiriske formel:
* Den empiriske formel er det enkleste forhold mellem hele nummeret for atomer i en forbindelse.
* Den empiriske formel for dette carbonhydrid er ch₂ .
 Varme artikler
Varme artikler
-
 Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne -
Forskere udvikler molekylær kode for melanin-lignende materialerPolymere pigmenter blev fremstillet ved guidet oxidation af peptidsamlinger. Kredit:Matej Vakula, NYC Forskere har længe vidst, at melanin - de pigmenter, der giver farve til huden, hår og øjne - -
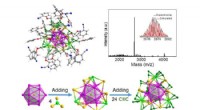 Forskere konstruerer M29-klyngemodelkatalysatorTotal struktur og negativ-mode ESI-massespektrum af Au 13 Ag 16 L 24 klynge, den Au@Ag 12 @Au 12 Ag 4 metalramme beskyttet af alkyngrupper fra 24 ligander. Kredit:QIN Zhaoxian For nyli
Forskere konstruerer M29-klyngemodelkatalysatorTotal struktur og negativ-mode ESI-massespektrum af Au 13 Ag 16 L 24 klynge, den Au@Ag 12 @Au 12 Ag 4 metalramme beskyttet af alkyngrupper fra 24 ligander. Kredit:QIN Zhaoxian For nyli -
 Ny overfladebehandling kan forbedre køleeffektivitetenEn glat overflade til væsker med meget lav overfladespænding fremmer dråbedannelse, lette varmeoverførslen. Kredit:Karim Khalil et al . I modsætning til vand, flydende kølemidler og andre væsk
Ny overfladebehandling kan forbedre køleeffektivitetenEn glat overflade til væsker med meget lav overfladespænding fremmer dråbedannelse, lette varmeoverførslen. Kredit:Karim Khalil et al . I modsætning til vand, flydende kølemidler og andre væsk -
 Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter
Maskinlæringssystem fremskynder opdagelsen af nye materialer til 3D-printKredit:Pixabay/CC0 Public Domain Den voksende popularitet af 3D-print til fremstilling af alle slags genstande, fra tilpasset medicinsk udstyr til billige hjem, har skabt mere efterspørgsel efter
- Hvis rækkefølgen af en kemisk reaktion med hensyn til en dens reaktanter er nul, hvordan påvirk…
- I verdens første, atomkraftmikroskop ser kemiske bindinger i individuelle molekyler (m/ video)
- Påvirker titaniumdioxid i fødevarer og nanomaterialer tarmmikrobiomet?
- YouTube gennemgår børneappen efter klager over indhold
- Hvorfor er solens atmosfære så varm? Rumfartøjet begynder at opklare vores stjerners mysterier
- Forsikringsselskaber bruger teknologi for at bejle til chauffører


