Hvad er entalpien af opløsningsammoniumchlorid?
Her er en sammenbrud:
* entalpi af løsning: Dette henviser til den varme, der er absorberet eller frigivet, når en mol af et stof opløses i en stor mængde opløsningsmiddel (typisk vand) ved konstant tryk.
* positiv entalpi: En positiv entalpi af opløsning indikerer, at processen er endotermisk, hvilket betyder, at varme absorberes fra omgivelserne. Dette resulterer i et fald i temperaturen på opløsningen.
Faktorer, der påvirker entalpi af opløsning:
* gitterenergi: Den energi, der kræves for at bryde bindingerne i det faste opløste stof.
* Hydratiseringsenergi: Energien frigivet, når de opløste ioner er omgivet af vandmolekyler.
* Intermolekylære kræfter: De attraktive kræfter mellem opløst stof og opløsningsmiddelmolekyler.
I tilfælde af ammoniumchlorid er gitterenergien relativt høj på grund af de stærke ioniske bindinger. Imidlertid er hydratiseringsenergien af ammonium- og chloridioner også signifikant, hvilket fører til en samlet positiv entalpi af opløsning.
Eksperimentel observation:
Hvis du opløser ammoniumchlorid i vand, vil du bemærke, at opløsningen føles kold. Dette skyldes, at opløsningsprocessen absorberer varme fra omgivelserne, hvilket gør beholderen og opløsningen koldere.
Sidste artikelHvilken reaktion får du, når du blandes klor med motorolie?
Næste artikelHvad er formen på fosfation?
 Varme artikler
Varme artikler
-
 Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer
Første detaljerede kig på afgørende enzym fremmer kræftforskningenPetra Fromme er direktør for Biodesign Center for Applied Structural Discovery. Hun er også Regents Professor ved ASUs School of Molecular Sciences. Kredit:Biodesign Institute ved Arizona State Univer -
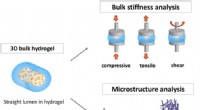 Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid
Semi-fleksibel modelbaseret analyse af celleadhæsion til hydrogelerSkematisk repræsentation af metoder til karakterisering af hydrogels fysiske egenskaber:hydrogels bulkstivhed og kædefleksibilitet i viskoelastiske netværk gennem den semi-fleksible model. Kredit: Vid -
 Ny teknik kan gøre opfanget kulstof mere værdifuldtElektrolyseopsætningen, der kunne tillade effektiv produktion af syngas fra opfanget kulstof. Kredit:Idaho National Laboratory Kulstoffangst kan hjælpe landets kulværker med at reducere drivhusgas
Ny teknik kan gøre opfanget kulstof mere værdifuldtElektrolyseopsætningen, der kunne tillade effektiv produktion af syngas fra opfanget kulstof. Kredit:Idaho National Laboratory Kulstoffangst kan hjælpe landets kulværker med at reducere drivhusgas -
 Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
Fryseramme:Forskere løser, hvordan celler folder proteiner udKredit:CC0 Public Domain En glad celle er en balanceret celle, men for hvert fantastisk snoet protein, det skaber, den skal rive de gamle i stykker. Det betyder at udrede en indviklet kringleligne
- Hvad er massen på måne på en 10 n objekt jord?
- Eksotiske legeringer til potentielle energianvendelser
- Hvad er et virkeligt eksempel på cinderkegle vulkan?
- Hvad er stjernerne i Andromeda -konstellationen?
- Det er vigtigt at drage konklusioner fra videnskabelig information?
- Spændende opdagelse:Japansk videnskabsmand bruger æggehvide til ren energi


