Hvad er forbrændingsligningen?
brændstof + oxidant → Produkter + energi
hvor:
* brændstof: Det stof, der er brændt. Eksempler inkluderer træ, propan, naturgas og benzin.
* Oxidant: Det stof, der understøtter forbrænding. Den mest almindelige oxidant er ilt.
* Produkter: Stofferne produceret af forbrændingsreaktionen. Disse inkluderer typisk kuldioxid (CO2), vand (H2O) og andre gasser.
* Energi: Varmen og lyset frigivet under forbrænding.
Eksempel:
Forbrændingen af metan (CH4), hovedkomponenten i naturgas, er repræsenteret af følgende afbalancerede ligning:
CH4 + 2O2 → CO2 + 2H2O + Energi
I denne ligning:
* Methan (CH4) er brændstof.
* Oxygen (O2) er oxidanten.
* Kuldioxid (CO2) og vand (H2O) er produkterne.
* Energi frigøres i form af varme og lys.
Bemærk:
* Koefficienterne i den afbalancerede ligning repræsenterer de støkiometriske forhold mellem reaktanterne og produkterne.
* Typen af forbrændingsreaktion kan variere afhængigt af brændstof og betingelser. For eksempel producerer komplet forbrænding kun kuldioxid og vand, mens ufuldstændig forbrænding også producerer kulilte og andre forurenende stoffer.
* Forbrænding er en eksoterm reaktion, hvilket betyder, at den frigiver energi i omgivelserne.
Forbrændingsligningen er et grundlæggende koncept inden for kemi og er vigtig for at forstå de processer, der er involveret i brændende brændstoffer og produktionen af energi.
 Varme artikler
Varme artikler
-
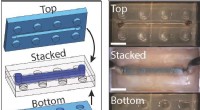 Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b
Dynamisk hydrogel bruges til at lave bløde robotkomponenter og LEGO-lignende byggeklodserLEGO-lignende hydrogel byggeklodser mønstret med bittesmå væskekanaler kan samles til komplekse mikrofluidiske enheder og derefter forsegles tæt sammen. Kredit:Wong Lab / Brown University Ved at b -
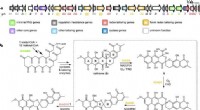 Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe
Nøgleenzymer til syntetisering af naturlige produkterOversigt over den foreslåede biosyntese af bakterielle rubromycin-type polyketider og endelige pathway-produkter. Kredit: Naturkommunikation (2021). DOI:10.1038/s41467-021-21432-9 Planter, svampe -
 Hvordan kan forskere hurtigt få adgang til komplekse molekyler til lægemiddelopdagelse?Kredit:Pixabay/CC0 Public Domain Funktionen af molekyler, der bruges i lægemidler, afhænger delvist af deres struktur, herunder de mange kemiske bindinger mellem deres atomer. Disse molekyler ka
Hvordan kan forskere hurtigt få adgang til komplekse molekyler til lægemiddelopdagelse?Kredit:Pixabay/CC0 Public Domain Funktionen af molekyler, der bruges i lægemidler, afhænger delvist af deres struktur, herunder de mange kemiske bindinger mellem deres atomer. Disse molekyler ka -
 Langtidsvarmelagrende keramik absorberer termisk energi fra varmt vandFørste-princippets beregninger af dannelsesenergier. (A) Periodisk system farvet af de samlede elektroniske energier af λ-Ti3O5 med en elementær substitution. Blå grundstoffer er dem, hvor substituere
Langtidsvarmelagrende keramik absorberer termisk energi fra varmt vandFørste-princippets beregninger af dannelsesenergier. (A) Periodisk system farvet af de samlede elektroniske energier af λ-Ti3O5 med en elementær substitution. Blå grundstoffer er dem, hvor substituere
- Hvordan dannes elektrisk feltintensitet?
- Den sidste neandertaler halskæde
- Hvor kom stof fra, hvis det ikke kan skabes?
- ROBOSHERLOCK:et system til at forbedre robottens ydeevne ved manipulationsopgaver
- Hvad er forskellen mellem nøjagtighed og præcision inden for videnskab?
- Falske nyheder øger forbrugernes krav om virksomhedshandlinger


