Hvordan redegør du for den observerede opløselighed af naphthalen og natriumchlorid i vandether baseret på naturbindinger, der findes dem?
naphthalen (c₁₀h₈)
* struktur: Naphthalen er et ikke -polært carbonhydrid med en plan struktur bestående af to smeltede benzenringe.
* obligationer: Det holdes sammen af stærke kovalente bindinger i molekylet, men disse er ikke -polære på grund af den lignende elektronegativitet af kulstof og brint.
* opløselighed:
* vand (H₂O): Vand er et meget polært opløsningsmiddel på grund af tilstedeværelsen af hydrogenbindinger mellem dets molekyler. Naphthalenes ikke -polære natur fører til dårlig interaktion med vandmolekyler. Derfor er det uopløseligt i vand .
* diethylether (ch₃ch₂och₂ch₃): Diethylether er et mindre polært opløsningsmiddel end vand. Det har også en ikke -polær carbonhydridkæde, der giver den mulighed for at interagere med Naphthalenes ikke -polære struktur gennem London -spredningskræfter . Dette gør naphthalen opløselig i diethylether .
natriumchlorid (NaCl)
* struktur: Natriumchlorid er en ionisk forbindelse, der består af Na⁺ -kationer og cl⁻ -anioner, der holdes sammen af stærke elektrostatiske attraktioner.
* obligationer: Ioniske bindinger findes mellem natrium- og chloridioner.
* opløselighed:
* vand (H₂O): Vands høje polaritet og evne til at danne hydrogenbindinger gør det muligt for det effektivt at solvere ionerne i NaCI. De delvise negative ladninger på ilt i vandmolekyler tiltrækker natriumioner, mens de delvise positive ladninger på brint tiltrækker chloridioner. Denne interaktion bryder det ioniske gitter og fører til opløsning af NaCl i vand .
* diethylether (ch₃ch₂och₂ch₃): Diethylether er et ikke -polært opløsningsmiddel. Det kan ikke overvinde de stærke elektrostatiske kræfter, der holder natrium- og chloridioner sammen. Som et resultat er NaCl uopløselig i diethylether .
Nøgle takeaways:
* "Ligesom opløser som" Princip: Polære stoffer har en tendens til at opløses i polære opløsningsmidler, og ikke -polære stoffer opløses i ikke -polære opløsningsmidler.
* Intermolekylære kræfter: Typen og styrken af intermolekylære kræfter (hydrogenbinding, dipol-dipol-interaktioner, London-spredningskræfter) påvirker opløselighed.
Fortæl mig, hvis du har flere spørgsmål!
Sidste artikelHvordan eksploderer klor, når den blandes med vand?
Næste artikelHvad er forbrændingsligningen?
 Varme artikler
Varme artikler
-
 Proteiner koreograferer den uendelig lille dans af levende celler og funktionelle biomaterialerBlomsterlignende mikrostrukturer dannes på en nanoporøs glasmonolit med 31nm-diameter porer. Kredit:Lehigh University, Thamma, Kowal, Falk, Jain Et tværfagligt forskerhold ved Lehigh University ha
Proteiner koreograferer den uendelig lille dans af levende celler og funktionelle biomaterialerBlomsterlignende mikrostrukturer dannes på en nanoporøs glasmonolit med 31nm-diameter porer. Kredit:Lehigh University, Thamma, Kowal, Falk, Jain Et tværfagligt forskerhold ved Lehigh University ha -
 Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort
Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort -
 Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G
Forskere har opdaget nye forbindelser med herbicid potentiale fra havsvampOlesya Zhuravleva, Ph.D., Leder af Laboratoriet for biologisk aktive forbindelser, FEFU Naturvidenskabelige Skole. Kredit:FEFUs pressekontor Forskere ved Far Eastern Federal University (FEFU) og G -
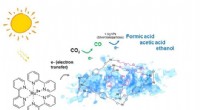 Ny lysaktiveret katalysator fanger CO2 for at lave ingredienser til brændstofSkematisk af en svampet nikkel-organisk fotokatalysator, der udelukkende omdanner carbondioxid til carbonmonoxid, som yderligere kan omdannes til flydende brændstof af høj værdi gennem synlig lys-indu
Ny lysaktiveret katalysator fanger CO2 for at lave ingredienser til brændstofSkematisk af en svampet nikkel-organisk fotokatalysator, der udelukkende omdanner carbondioxid til carbonmonoxid, som yderligere kan omdannes til flydende brændstof af høj værdi gennem synlig lys-indu
- Hvilket udtryk indikerer absorberende energi?
- Kan en kraft sætte en ubevægelig genstand i bevægelse?
- Sådan finder du vindende sæd:Undersøg deres racerstriber
- Fossile tænder fra Kenya løser ældgammelt abemysterium
- Konjugering overfører en egenskab fra en bakterie til en anden via en lille DNA-streng kaldet plasm…
- Akademisk advarer om dybhavsminedrift kan påvirke CO2-absorptionshastigheden i havets økosystemer


