Beskriv strukturen af et fluoratom?
atomnummer: 9
atomisk symbol: F
Antal protoner: 9
Antal elektroner: 9
Antal neutroner: 10 (for den mest almindelige isotop, fluor-19)
struktur:
* kerne: I midten af atomet indeholder kernen 9 protoner og 10 neutroner. Protonerne giver atomet sin positive ladning, og neutronerne bidrager til atomets masse.
* Elektronskaller: Omkring kernen er elektronskaller, der holder de negativt ladede elektroner. Fluor har to elektronskaller:
* første shell (k shell): Denne skal er fyldt med 2 elektroner.
* anden skal (l shell): Denne skal har de resterende 7 elektroner.
Valenselektroner: Den yderste skal af et atom, valensskallen, bestemmer atomets kemiske egenskaber. Fluor har 7 valenselektroner i sin anden skal. Dette betyder, at det kun har brug for endnu en elektron for at opnå en stabil, fyldt ydre skal (som de ædle gasser). Dette gør fluor til et meget reaktivt element, da det let får et elektron til at danne en negativ ion (F-).
diagram:
Du kan finde mange diagrammer over fluoratomet online. En simpel repræsentation ville være:
`` `
2e-
/ \
7e- 7e-
/ \ / \
F --- Nucleus (9p+, 10n)
\ / \ /
\ / \ /
2e-
`` `
Nøglepunkter:
* Fluor er et halogen, en meget reaktiv gruppe af ikke-metalliske elementer.
* Dens høje reaktivitet skyldes dens behov for endnu en elektron for at opnå en stabil oktet.
* Fluor er det mest elektronegative element, hvilket betyder, at det stærkt tiltrækker elektroner i kemiske bindinger.
* Fluor findes som en diatomisk gas (F2) ved stuetemperatur.
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse aspekter!
Sidste artikelHvilke typer metaller ruster ikke?
Næste artikelHvad er forskellen mellem tabletter jernholdig fumarat og sulfat?
 Varme artikler
Varme artikler
-
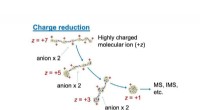 Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende
Et kæmpe fremskridt inden for spektrometriEn afbildning af ladningsreduktionsproces, der bruges som en forbehandlingsproces af massespektrometri, MS (eller ionmobilitetsspektrometri, IMS). For at øge nøjagtigheden af spektrum, overskydende -
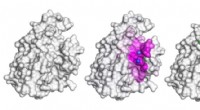 Neuralt netværk registrerer protein-peptidbindingssteder for at sætte gang i opdagelsen af pepti…Den grå form er et protein. For scenariet med dette proteinbinding til peptidet vist som en grønlig stick-and-ball model til højre, modellen præsenteret i undersøgelsen fremhæver overfladen involveret
Neuralt netværk registrerer protein-peptidbindingssteder for at sætte gang i opdagelsen af pepti…Den grå form er et protein. For scenariet med dette proteinbinding til peptidet vist som en grønlig stick-and-ball model til højre, modellen præsenteret i undersøgelsen fremhæver overfladen involveret -
 Konstruerede bakterier udskiller kræftbiomarkørerEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Skam med glycanen - disse komplekse sukkermolekyler er knyttet til 80% af proteinerne i den menneskelige krop, gør dem til en væsen
Konstruerede bakterier udskiller kræftbiomarkørerEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Skam med glycanen - disse komplekse sukkermolekyler er knyttet til 80% af proteinerne i den menneskelige krop, gør dem til en væsen -
 3D-billeddannelse af overfladekemi i indespærringForskere afbildede grænsefladekemien i den mikroskopisk afgrænsede geometri af en simpel mikrokapillær af glas. Kredit:@EPFL / Alain Herzog EPFL -forskere har udviklet et optisk billeddannelsesvær
3D-billeddannelse af overfladekemi i indespærringForskere afbildede grænsefladekemien i den mikroskopisk afgrænsede geometri af en simpel mikrokapillær af glas. Kredit:@EPFL / Alain Herzog EPFL -forskere har udviklet et optisk billeddannelsesvær
- Genplantning af amerikansk muldjord gemmer enorme mængder kulstof, med potentiale til meget mere
- En uge efter, at fuldmåne ser ud som en semi -cirkel igen, kaldes denne fase?
- Et apparat som en Cavendish, der plejede at finde G, har en stor blybugle, der er 5,2 kg i masse og …
- Opdagelse af nøjagtig og langt mere effektiv algoritme til problemer med registrering af punktsæt
- Hvad gør et godt træ? Vi brugte AI til at spørge fugle
- Hvorfor er det vanskeligt at undersøge?


