Hvorfor fluor er mere reaktiv end brint?
1. Elektronegativitet: Fluor har den højeste elektronegativitet af alle elementer. Dette betyder, at det har en stærk attraktion for elektroner. Når fluor reagerer, trækker den let elektroner væk fra andre atomer, danner stærke bindinger og frigiver en masse energi.
2. Lille atomstørrelse: Fluor er et meget lille atom, hvilket betyder, at dets elektroner er tæt på kernen. Dette gør det lettere for fluor at tiltrække elektroner fra andre atomer.
3. Svag F-F-obligation: Bindingen mellem to fluoratomer i F2 -molekylet er relativt svagt. Dette skyldes frastødelsen mellem elektronskyerne af de to fluoratomer. Denne svaghed gør det lettere for fluor at bryde dens binding og reagere med andre elementer.
4. Lav ioniseringsenergi: Fluor har en relativt lav ioniseringsenergi, hvilket betyder, at den let mister et elektron til at danne en negativ ion (F-). Dette gør det til et stærkt oxidationsmiddel, hvilket betyder, at det let accepterer elektroner fra andre atomer.
I modsætning:
* Hydrogen er et relativt lille atom, men det har en meget lavere elektronegativitet end fluor. Det har også en meget stærkere H-H-binding sammenlignet med F-F-bindingen.
Disse faktorer bidrager til fluorens ekstremt høje reaktivitet, hvilket gør det til et af de mest reaktive elementer på den periodiske tabel.
Sidste artikelHvilken type reaktion er cyclohexen og brom?
Næste artikelHvorfor er svovldioxid nødvendigt i papirfremstilling?
 Varme artikler
Varme artikler
-
 Verdens første produktion af aluminium scandium nitrid via MOCVDForskere ved Fraunhofer IAF er verdens første til at producere aluminium scandium nitrid (AlScN) via metal-organisk kemisk dampaflejring (MOCVD). Forskergruppen af Stefano Leone (nederst til højre)
Verdens første produktion af aluminium scandium nitrid via MOCVDForskere ved Fraunhofer IAF er verdens første til at producere aluminium scandium nitrid (AlScN) via metal-organisk kemisk dampaflejring (MOCVD). Forskergruppen af Stefano Leone (nederst til højre) -
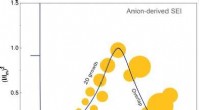 Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro
Anioner og opløsningsmidler styrer kernedannelse og vækst af den faste elektrolyt-interfase© Wiley-VCH. Kredit:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494 Batterier oplades og genoplades - tilsyneladende alt sammen takket være et perfekt samspil mellem elektro -
 Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige
Overflademodifikation for at forbedre in vivo-levetiden for bioimplantaterKredit:Frontiers of Mechanical Engineering . DOI:10.1007/s11465-022-0682-6 For nylig har forskere fra University College Dublin lavet nogle nye udviklinger for at øge in vivo-levetiden for kunstige -
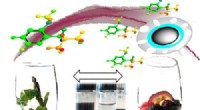 Magnetisk behandling kan hjælpe med at fjerne bismag fra vineKredit:American Chemical Society Magnetiske nanopartikler knyttet til polymerer er med succes blevet brugt til at målrette og fjerne uønskede smagsstoffer fra vin. Forskere ved University of Adel
Magnetisk behandling kan hjælpe med at fjerne bismag fra vineKredit:American Chemical Society Magnetiske nanopartikler knyttet til polymerer er med succes blevet brugt til at målrette og fjerne uønskede smagsstoffer fra vin. Forskere ved University of Adel
- Hvad er rollen som en geolog i petroleumsindustrien?
- Lærere arret af arven fra 1988 anti-LGBT+ lov
- Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærer
- Fiskestang selfie stick og videnskabelig efterforskning viser spor til uddøde havkrybdyr
- Flytter det hurtigere dit køretøj mindre kinetisk energi, det har?
- Forståelse af den optimale proces til fremstilling af koblede nanokrystalfaststoffer


