Hvorfor har natriumchlorid og cæsium forskellige strukturer?
natriumchlorid (NaCl):
* struktur: Face-centreret kubisk (FCC) gitter.
* ionisk radier: Natriumion (Na+) er meget mindre end chloridionen (Cl-).
* Pakning: De mindre Na+ -ioner passer ind i de octahedrale hulrum (rum) inden for FCC-gitteret dannet af de større klodser.
cesiumchlorid (CSCL):
* struktur: Enkel kubisk gitter.
* ionisk radier: Cesiumion (CS+) er signifikant større end chloridionen (Cl-).
* Pakning: På grund af den store størrelse af CS+ -ionen er det mere effektivt at få den til at besætte det kubiske tomrum i midten af den kubiske enhedscelle, med de mindre klodser i hjørnerne.
Nøglefaktorer:
* ionisk radii -forhold: Forholdet mellem den kationiske radius og den anioniske radius (R+/R-) spiller en afgørende rolle i bestemmelsen af krystalstrukturen. For NaCl er R+/R-forholdet lille (ca. 0,5), hvilket favoriserer octahedral koordination. For CSCL er R+/R-forholdet tættere på 1, hvilket favoriserer kubisk koordinering.
* Elektrostatiske interaktioner: Strukturen afhænger også af balancen mellem elektrostatiske kræfter mellem ionerne. Jo større forskellen i størrelse er, desto mere sandsynligt er det for, at den mindre ion er omgivet af et større antal modsat ladede ioner.
I resumé driver forskellen i størrelse mellem kationerne og anionerne de forskellige strukturer af NaCl og CSCL. Natriumchlorid vedtager en ansigtscentreret kubisk struktur med de mindre natriumioner, der passer ind i de oktaedriske hulrum, mens cæsiumchlorid vedtager en simpel kubisk struktur med den større cæsiumion, der optager det centrale tomrum.
 Varme artikler
Varme artikler
-
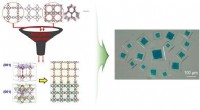 Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer
Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer -
 Proteser med kontrolleret nedbrydningshastighedUdseende af overfladen af laget af calciumphosphat. Kredit:Nuria Monasterio / UPV / EHU Da magnesiumlegeringer er nedbrydelige, de kunne give et alternativ til de metaller, der traditionelt brug
Proteser med kontrolleret nedbrydningshastighedUdseende af overfladen af laget af calciumphosphat. Kredit:Nuria Monasterio / UPV / EHU Da magnesiumlegeringer er nedbrydelige, de kunne give et alternativ til de metaller, der traditionelt brug -
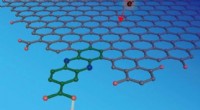 Eksperimenter og analyser viser, hvordan elektroner og protoner samles på en elektrodeoverfladeVed at inkorporere præcise molekylære steder (afbildet med grønt) i grafitelektroder (vist som det grå gitter), forskerne var i stand til at studere interaktionerne mellem en proton (en brintkerne, vi
Eksperimenter og analyser viser, hvordan elektroner og protoner samles på en elektrodeoverfladeVed at inkorporere præcise molekylære steder (afbildet med grønt) i grafitelektroder (vist som det grå gitter), forskerne var i stand til at studere interaktionerne mellem en proton (en brintkerne, vi -
 Forskere producerer de første open source-all-atom-modeller af COVID-19 spike proteinEn model af et S-protein. Kredit:Dr. Yeolkyo Choi/Lehigh Virus SARS coronavirus 2 (SARS-CoV-2) er den kendte årsag til coronavirus sygdom 2019 (COVID-19). Spike- eller S-proteinet letter viral ind
Forskere producerer de første open source-all-atom-modeller af COVID-19 spike proteinEn model af et S-protein. Kredit:Dr. Yeolkyo Choi/Lehigh Virus SARS coronavirus 2 (SARS-CoV-2) er den kendte årsag til coronavirus sygdom 2019 (COVID-19). Spike- eller S-proteinet letter viral ind
- Er det sandt, at den større amplitude af mindre energi transporteres med bølge?
- Quantum dot -belysningsteknologi tager et spring fremad takket være den nye supersyrebehandling
- Indeholder den menneskelige krop nitrogen?
- Hvad er et økosystem og anfør den biotiske abiotiske del af det?
- Hvordan forstærker linserne i et mikroskop et billede?
- Billede:Hubble fanger stjerneskud i en spærret spiralgalakse


