Hvad er usædvanligt ved den isotopiske sammensætning af brom?
Her er grunden til, at dette er usædvanligt:
* De fleste elementer har en dominerende isotop: En isotop af et element er typisk markant mere rigeligt end de andre. For eksempel har Carbon en dominerende isotop, carbon-12, der udgør 98,9% af alt kulstof.
* Brom har en næsten perfekt 50/50 split: Brom-79 og brom-81 findes i næsten nøjagtigt et forhold på 1:1. Dette gør brom lidt af en outlier med hensyn til isotopisk overflod.
Denne næsten ligestillede overflod af de to bromisotoper har et par implikationer:
* atommasse er ikke et helt tal: Atommassen af brom er 79.904, hvilket afspejler gennemsnittet af dets to isotoper. Dette er ikke et helt tal, i modsætning til mange andre elementer.
* analytiske applikationer: Den næsten lige store overflod gør det lettere at analysere brom ved hjælp af teknikker som massespektrometri.
Mens årsagen til denne næsten perfekte 50/50 split ikke forstås fuldt ud, antages det at være relateret til bromens nukleare egenskaber og dens position på den periodiske tabel.
Sidste artikelHvad er sammensætningen af doloston?
Næste artikelHvad gør svovlmonoxid?
 Varme artikler
Varme artikler
-
 Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde
Svampe, fjer kombineres i biologisk nedbrydelige skoTo University of Delaware-studerende har lavet en biologisk nedbrydelig sko ved hjælp af svampe, kyllingefjer og tekstilaffald. Prototypeskoen består af en myceliumbaseret sål, dækket med vegansk læde -
 Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover
Løsningsbehandlede OLED'er baner vejen for fremtidige belysningsapplikationerKredit:Shutterstock Før det kan overtage vores gader og hjem, OLED-belysning skal gøres mere tilgængelig. SOLEDLIGHT-projektet har udviklet nye flerlags OLEDer takket være en ny proces, der lover -
 Sæbe fra halm - forskere udvikler miljøvenlig ingrediens fra landbrugsaffaldPå billedet her er Dr. Pattanathu Rahman, mikrobiel bioteknolog fra University of Portsmouth og direktør for TeeGene. Kredit:University of Portsmouth En videnskabsmand har opdaget en måde at bruge
Sæbe fra halm - forskere udvikler miljøvenlig ingrediens fra landbrugsaffaldPå billedet her er Dr. Pattanathu Rahman, mikrobiel bioteknolog fra University of Portsmouth og direktør for TeeGene. Kredit:University of Portsmouth En videnskabsmand har opdaget en måde at bruge -
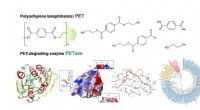 Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
Strukturel indsigt i den molekylære mekanisme ved PET -nedbrydningStrukturel indsigt i den molekylære mekanisme ved poly (ethylenterephthalat) nedbrydning og det fylogenetiske træ af mulige PET -nedbrydende enzymer. Kredit:KAIST Et KAIST metabolisk ingeniørunder
- Hvad er Continental Drift Theory af Alfred?
- National abortundersøgelse finder out-of-touch etiketter, videnshuller, appetit på moralsk diskuss…
- Hvad er forskellen mellem thiamin og thiamin?
- Hvilken energikonvertering ooccur, når en switch er lukket?
- Kontinentstore plader, der udgør skorpen og den øverste mantel?
- Alger som mikroskopiske bioraffinaderier


