Hvad er opløseligheden af AUCL i en 0,2 m opløsning NaCl?
Forståelse af kemi
* guld (I) chlorid (AUCL): AUCL er en sparsomt opløselig ionisk forbindelse. Det opløses i vand i lille grad og danner guld (I) -ioner (Au+) og chloridioner (Cl-).
* fælles ioneffekt: Tilstedeværelsen af NaCl (en kilde til chloridioner) i opløsningen vil reducere opløseligheden af AUCL. Dette skyldes, at de tilsatte chloridioner skifter ligevægt af opløsningsreaktionen til venstre, hvilket favoriserer dannelsen af fast AUCL.
Beregninger
1. ligevægt: Skriv ligevægtsreaktionen for opløsningen af AUCL:
`` `
AUCL (S) <=> AU + (AQ) + CL- (AQ)
`` `
2. opløselighedsprodukt: Vi har brug for opløselighedsproduktkonstant (KSP) til AUCL. Denne værdi er ikke let tilgængelig, da AUCL ikke er en meget almindelig forbindelse. Du bliver sandsynligvis nødt til at slå det op i en specialiseret reference. For dette eksempel, lad os antage en hypotetisk KSP-værdi på 1,0 x 10^-10.
3. isbord: Opret en is (indledende, ændring, ligevægt) -tabel for at spore koncentrationerne:
| | Au+ | Cl- |
| -------------- | -------- | ------------ |
| Indledende | 0 | 0,2 |
| Ændring | +S | +S |
| Ligevægt | S | 0,2 + S |
* "S" repræsenterer den molære opløselighed af AUCL.
4. KSP -ekspression: Skriv KSP -udtrykket:
`` `
Ksp =[au+] [cl-]
`` `
5. erstatning og løsning: Udskift ligevægtskoncentrationerne fra isbordet i KSP -ekspressionen og løs for "S":
`` `
1,0 x 10^-10 =(s) (0,2 + s)
`` `
Da KSP er meget lille, kan vi antage den forenklende antagelse om, at 0,2 + s ≈ 0,2. Dette forenkler beregningen:
`` `
1,0 x 10^-10 =(s) (0,2)
s =5,0 x 10^-10 m
`` `
Konklusion
Opløsningen af AUCl i en 0,2 M NaCl-opløsning er ca. 5,0 x 10^-10 M. Denne værdi er signifikant lavere end opløseligheden af AUCl i rent vand, hvilket demonstrerer den almindelige ioneffekt.
Vigtige noter:
* Find KSP: KSP -værdien for AUCL er afgørende for denne beregning. Det er vigtigt at finde en pålidelig kilde til disse oplysninger.
* antagelser: Antagelsen om, at 0,2 + s ≈ 0,2 er gyldig, fordi KSP er meget lille. Hvis KSP var større, ville en mere streng løsning ved hjælp af den kvadratiske formel være nødvendig.
* Overvejelser i den virkelige verden: Opløseligheden af AUCL kan påvirkes af andre faktorer som pH, temperatur og tilstedeværelsen af andre komplekse midler.
 Varme artikler
Varme artikler
-
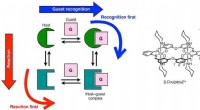 Styring af iongenkendelse i reaktive værts-gæstesystemerIllustration af scenarierne reaktion først og anerkendelse først i reaktive vært-gæst-systemer (til venstre) og værtsmolekylet og dets skematiske fremstilling, der bruges af Akine og kolleger (til høj
Styring af iongenkendelse i reaktive værts-gæstesystemerIllustration af scenarierne reaktion først og anerkendelse først i reaktive vært-gæst-systemer (til venstre) og værtsmolekylet og dets skematiske fremstilling, der bruges af Akine og kolleger (til høj -
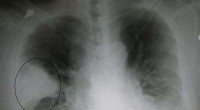 Undersøgelse afslører nye resultater om antimikrobiel lægemiddelsynergiEt sort-hvidt røntgenbillede, der viser et trekantet hvidt område på venstre side. En cirkel fremhæver området. Kredit:James Heilman, MD./Wikipedia Nye data fra en undersøgelse ledet af forskere f
Undersøgelse afslører nye resultater om antimikrobiel lægemiddelsynergiEt sort-hvidt røntgenbillede, der viser et trekantet hvidt område på venstre side. En cirkel fremhæver området. Kredit:James Heilman, MD./Wikipedia Nye data fra en undersøgelse ledet af forskere f -
 Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me
Ny metode gør det muligt at fotografere enzymerHvis den ændrer sin polaritet, dette forårsager et ekko i den magnetiske markør, hvorfra afstanden kan beregnes. Kredit:© AG Schiemann/Uni Bonn Forskere ved universitetet i Bonn har udviklet en me -
 Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu
Prøveopbevaringsmetode kunne forbedre sundhedsplejen i ressourcebegrænsede regionerKredit:offentlig ejendom Blod- og urinprøver spiller vitale roller i moderne medicin. Men i store områder af verden, hvor køling ikke er tilgængelig, at bevare prøver til test er praktisk talt umu
- Forbigående mikroelektromekaniske systemer, der kan selvopløses over tid
- Kan du give 20 eksempler på substantiver?
- Kalder elefanter ''menneske!''?
- Hvordan fjerner fotosyntesen kulstof fra atmosfæren?
- Er fosfortrioxid en kovalent forbindelse?
- Den usynlige katalysator, der kan overlade kemiske reaktioner


