Hvad fremskynder reaktionen og bremser reaktionen?
faktorer, der fremskynder reaktioner
* Temperatur: Højere temperaturer giver molekyler mere kinetisk energi, hvilket fører til hyppigere og energiske kollisioner, hvilket øger sandsynligheden for reaktioner.
* Koncentration: Højere koncentrationer af reaktanter betyder, at flere molekyler er tilgængelige for at kollidere, hvilket øger reaktionshastigheden.
* overfladeareal: For reaktioner, der involverer faste stoffer, udsætter stigende overfladeareal (f.eks. Opdeling af et fast stof i mindre stykker) flere reaktantmolekyler for interaktion og fremskynder processen.
* katalysator: En katalysator er et stof, der fremskynder en reaktion uden at blive konsumeret i processen. Katalysatorer giver en alternativ reaktionsvej med lavere aktiveringsenergi.
* tryk (for gasser): Stigende tryk for reaktioner, der involverer gasser, øger koncentrationen af reaktanter, hvilket fører til flere kollisioner og en hurtigere hastighed.
faktorer, der bremser reaktioner
* Temperatur: Lavere temperaturer mindsker molekylernes kinetiske energi, hvilket fører til færre kollisioner og en langsommere reaktionshastighed.
* Koncentration: Lavere koncentrationer af reaktanter reducerer antallet af tilgængelige molekyler til at kollidere, hvilket bremser reaktionen.
* Inhibitor: En hæmmer er et stof, der bremser ned eller forhindrer en reaktion. Inhibitorer kan blokere det aktive sted for en katalysator eller forstyrre reaktionsmekanismen.
* tryk (for gasser): Faldende tryk for reaktioner, der involverer gasser, reducerer koncentrationen af reaktanter, hvilket resulterer i færre kollisioner og en langsommere hastighed.
nøglekoncepter
* Aktiveringsenergi: Den mindste mængde energi, der kræves for at en reaktion kan forekomme. Katalysatorer med lavere aktiveringsenergi, hvilket får reaktioner til at ske hurtigere.
* Kollisionsteori: For at en reaktion kan forekomme, skal reaktantmolekyler kollidere med tilstrækkelig energi og i den rigtige orientering.
Eksempler
* fremskynder: Madlavning af mad ved en højere temperatur får den til at koge hurtigere. Brug af en træburning pejs til at starte et lejrbål (katalysator).
* bremser: Opbevaring af mad i køleskabet bremser ødelæggelse (lavere temperatur). Tilføjelse af et konserveringsmiddel til mad (hæmmer).
Fortæl mig, hvis du gerne vil have flere detaljer om nogen af disse faktorer!
 Varme artikler
Varme artikler
-
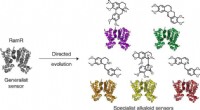 Forskere kaprer bakterier for at lette lægemiddelfremstillingenKredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01072-w For mere overkommelige, bæredygtige medicinmuligheder, end vi har i dag, kan den medicin, vi tager til behandling af forhøjet b
Forskere kaprer bakterier for at lette lægemiddelfremstillingenKredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01072-w For mere overkommelige, bæredygtige medicinmuligheder, end vi har i dag, kan den medicin, vi tager til behandling af forhøjet b -
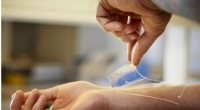 Nyt materiale til behandling af sår kan beskytte mod resistente bakterierForskere ved Chalmers Tekniske Universitet, Sverige, har udviklet et nyt materiale, der dræber bakterier og potentielt kan forhindre infektioner i sår - en specialdesignet hydrogel, der virker mod all
Nyt materiale til behandling af sår kan beskytte mod resistente bakterierForskere ved Chalmers Tekniske Universitet, Sverige, har udviklet et nyt materiale, der dræber bakterier og potentielt kan forhindre infektioner i sår - en specialdesignet hydrogel, der virker mod all -
 Video:Har astronauter brug for solcreme?Kredit:CC0 Public Domain Rummet er fuld af potentielt farlig stråling. Her på jorden, vores atmosfære og magnetfelt beskytter os mod det værste. Astronauter på en dyb rummission ville have brug f
Video:Har astronauter brug for solcreme?Kredit:CC0 Public Domain Rummet er fuld af potentielt farlig stråling. Her på jorden, vores atmosfære og magnetfelt beskytter os mod det værste. Astronauter på en dyb rummission ville have brug f -
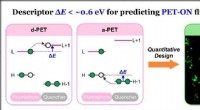 Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette
Generel beskrivelse sætter gang i fremskridt inden for farvestofkemiForskere fra SUTD, DICP, og POSTECH udviklede en teoretisk deskriptor ΔE til at forudsige PET-baserede fluorescensprober; ved at bruge denne deskriptor, de designede kvantitativt fluorescerende plette
- Hvilke stoffer er opløselige?
- Hvad er den primære energikilde?
- Hvad opvarmer jorden om dagen, og hvad køler den ned om natten?
- Hvad er de reaktioner, der kræves for at generere et aminoacyl -tRNA?
- Hvorfor er folk så bekymrede over, hvordan vores elektricitet genereres i fremtiden?
- Einstein-flisen:Matematikere finder en form, der aldrig gentager sig


