Hvad er elektronarrangementet for ilt?
1S² 2S² 2P⁴
Her er en sammenbrud:
* 1S²: Den første elektronskal (n =1) indeholder to elektroner i S orbital (L =0).
* 2s²: Den anden elektronskal (n =2) indeholder to elektroner i S orbital (L =0).
* 2p⁴: Den anden elektronskal indeholder også fire elektroner i P -orbitaler (L =1). P orbital har tre underorbitaler (PX, PY, PZ), der hver er i stand til at holde to elektroner. I ilt er disse underorbitaler fyldt med to elektroner hver, undtagen for en underorbital, der kun indeholder en elektron.
Denne ordning kan også repræsenteres på en mere visuel måde ved hjælp af følgende orbitaldiagram:
`` `
2p ↑ ↓ ↑ ↑
2s ↑ ↓
1s ↑ ↓
`` `
Denne ordning afspejler det faktum, at ilt har seks elektroner i sin yderste skal (n =2), hvilket gør det til et meget reaktivt element.
Sidste artikelNår der leveres varme til et fast stof?
Næste artikelHvilket metal er det mest almindeligt anvendte som dirigent?
 Varme artikler
Varme artikler
-
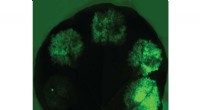 Nye syntetiske biologiværktøjer låser op for kompleks anlægsteknikEt blad med forskellige syntetiske promotorer, der udtrykker grønt fluorescerende protein, demonstrerer rækken af ekspressionsniveauer, der kan opnås med deres konstruerede promotorer. Kredit:JBEI/B
Nye syntetiske biologiværktøjer låser op for kompleks anlægsteknikEt blad med forskellige syntetiske promotorer, der udtrykker grønt fluorescerende protein, demonstrerer rækken af ekspressionsniveauer, der kan opnås med deres konstruerede promotorer. Kredit:JBEI/B -
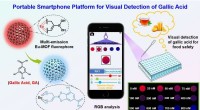 Ny fluorescenssensorplatform udviklet til visuel overvågning af fødevaresikkerhedDen bærbare smartphone-platform baseret på dual-emission Eu-MOF til visuel påvisning af gallussyre i fødevaresikkerheden. Kredit:Pan Lei Et forskerhold ledet af prof. Jiang Changlong fra Institute
Ny fluorescenssensorplatform udviklet til visuel overvågning af fødevaresikkerhedDen bærbare smartphone-platform baseret på dual-emission Eu-MOF til visuel påvisning af gallussyre i fødevaresikkerheden. Kredit:Pan Lei Et forskerhold ledet af prof. Jiang Changlong fra Institute -
 Musestudie identificerer ny forbindelse, der kan hjælpe med at udvikle diabetesmedicinKredit:CC0 Public Domain Forskning ledet af Ohio State University Wexner Medical Center og College of Medicine identificerede en ny forbindelse, der kan tjene som grundlag for at udvikle en ny kla
Musestudie identificerer ny forbindelse, der kan hjælpe med at udvikle diabetesmedicinKredit:CC0 Public Domain Forskning ledet af Ohio State University Wexner Medical Center og College of Medicine identificerede en ny forbindelse, der kan tjene som grundlag for at udvikle en ny kla -
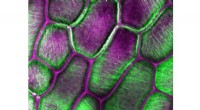 Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup
Nye cellulosefund kan føre til nye kemikalier, biobrændstofferForskere afslørede den snoede krystalorientering af cellulosefibre, afbilledet her i grønt i cellerne i en løgskal. Kredit:Edward Wagner, Cosgrove Lab, Penn State En multiinstitutionel forskergrup
- Hvilke kemiske og fysiske elementer udgør fosfat?
- Hvilken slags remskive har en ideel mekanisk fordel 2?
- Hvem sagde, at elektroner rejser i bestemte stier?
- Hvilket antal repræsenterer 988.35 skrevet i videnskabelig notation?
- Optimal ressourceallokering til UAV-kommunikationssystemer i katastrofehåndtering
- Hvad er PSI på 5400 fod under vand?


