Hvad er et krystallinsk stof?
Her er nogle nøgleegenskaber ved krystallinske stoffer:
* bestilt struktur: Atomer, molekyler eller ioner er arrangeret i et specifikt, gentagende mønster.
* rækkefølge: Dette mønster strækker sig gennem hele krystalen.
* skarpt smeltepunkt: Krystallinske stoffer smelter ved en bestemt temperatur, i modsætning til amorfe faste stoffer, der blødgøres over en række temperaturer.
* anisotropi: De kan have forskellige fysiske egenskaber i forskellige retninger. For eksempel kan en krystal være sværere i en retning end en anden.
* spaltning: De har en tendens til at bryde langs specifikke fly på grund af den ordnede struktur.
* diffraktion: Røntgenstråler kan diffraheres af det almindelige arrangement af atomer i en krystal, hvilket giver information om krystalstrukturen.
Eksempler på krystallinske stoffer:
* salt (NaCl): Et klassisk eksempel på en ionisk krystal.
* kvarts (SiO2): Et mineral med et tetrahedralt arrangement af silicium- og iltatomer.
* diamant (c): Et kovalent netværk solidt med en kubisk krystalstruktur.
* sukker (C12H22O11): En molekylær krystal med en kompleks, men meget ordnet struktur.
Sammenligning med amorfe stoffer:
Amorfe stoffer, som glas, har ikke denne langtrækkende orden og er mere forstyrrede. De mangler det skarpe smeltepunkt og andre egenskaber ved krystallinske faste stoffer.
At forstå strukturen og egenskaberne af krystallinske stoffer er vigtig inden for felter som materialevidenskab, geologi og kemi.
Sidste artikelHvad er anvendelserne af helium-3?
Næste artikelHvilke materialer har en stærk modstand mod strømmen af elektroner?
 Varme artikler
Varme artikler
-
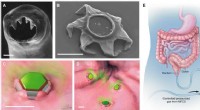 Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t
Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t -
 Molekyle fra naturen giver fuldt genanvendelige polymererForskere fra University of Groningen (Holland) og East China University of Science and Technology (ECUST) i Shanghai producerede forskellige polymerer ud fra liponsyre, et naturligt molekyle. Disse po
Molekyle fra naturen giver fuldt genanvendelige polymererForskere fra University of Groningen (Holland) og East China University of Science and Technology (ECUST) i Shanghai producerede forskellige polymerer ud fra liponsyre, et naturligt molekyle. Disse po -
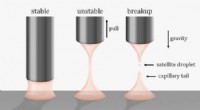 Et nyt twist til at bryde viskoelastiske væskebroerDen konventionelle metode til at bryde væskebroer bruger tilbagetrækning. Når dysen (eller pladen) løftes, væskebroen strækker sig og knækker. Dette kan danne kapillærhaler og satellitdråber. Forskere
Et nyt twist til at bryde viskoelastiske væskebroerDen konventionelle metode til at bryde væskebroer bruger tilbagetrækning. Når dysen (eller pladen) løftes, væskebroen strækker sig og knækker. Dette kan danne kapillærhaler og satellitdråber. Forskere -
 Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi
Hærens forskning lyser vejen for nye materialerUS Army Research Laboratory forskere Dr. David Baker og Dr. Joshua McClure poserer i deres laboratorium på Adelphi Laboratory Center, hvor de arbejder på at lette byrden og forbedre styrken af Soldi
- Amazonas skovrydning og brande er en fare for folkesundheden
- Forbedring af nanoterapeutisk vaccinelevering
- Hvad er hentydningen til at rejse sig i solen?
- Tre hydroxidioner er nødvendige for at danne en neutral ionforbindelse med en aluminiumion?
- Lava flydede 9,3 kilometer pr. Time Lava nåede havet om 3 timer Hvor mange er der fra kilden til la…
- To-i-en punch slår medicinresistente kræftceller ud


