Hvad kan du forudsige om egenskaberne ved Xenon og Helium?
Forudsigelse af egenskaber ved Xenon og Helium:
Både Xenon (XE) og helium (HE) er ædelgasser, hvilket betyder, at de er placeret i gruppe 18 i den periodiske tabel og har en fuld ydre skal af elektroner. Dette gør dem ekstremt ureaktive og stabile. Der er dog forskelle i deres egenskaber baseret på deres positioner i den periodiske tabel og atomstørrelse:
Xenon (XE):
* Større atomradius: Xenon har en meget større atomradius end helium. Dette skyldes det større antal elektronskaller i Xenon.
* Højere kogepunkt: Som et resultat af sin større størrelse og stærkere London -spredningskræfter har Xenon et markant højere kogepunkt end helium.
* Potentiale for reaktivitet: Mens det stadig er ureaktivt, gør Xenons større størrelse og svagere ioniseringsenergi det mere sandsynligt at danne forbindelser end helium. Det har vist sig at danne forbindelser med fluor og ilt.
* Potentiale til brug i lasere og belysning: Xenons større atomstørrelse og tilstedeværelsen af tungere isotoper gør det nyttigt i gaslasere og belysning med høj intensitet.
helium (He):
* mindre atomradius: Helium har den mindste atomradius blandt alle elementer, hvilket gør den meget kompakt.
* Lavest kogepunkt: På grund af sin lille størrelse og svage London -spredningskræfter har Helium det laveste kogepunkt for alle elementer.
* Ekstrem ureaktivitet: Heliums fulde ydre skal og lille størrelse gør det utroligt ureaktivt. Det danner sjældent forbindelser.
* Bruger i kryogenik og opdrift: Heliums lave kogepunkt gør det til en vigtig komponent i kryogenik, og dens lave tæthed gør det nyttigt til at blæse balloner og luftskibe.
Kortfattet:
Mens begge elementer er ædle gasser, fører deres størrelse og reaktivitetsforskelle til forskellige applikationer og egenskaber. Xenons større størrelse gør det potentielt mere reaktivt og nyttigt til lasere og belysning, mens Heliums lille størrelse og lave kogepunkt gør det til et vigtigt element i kryogeniske og opdriftsanvendelser.
 Varme artikler
Varme artikler
-
 Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer
Ny metode til isolering af tumorceller kan forbedre kræftforskning og -behandlingLeidong Mao (til venstre), en lektor ved UGA College of Engineering arbejdede sammen med ph.d.-studerende Wujun Zhao om at udvikle en ny enhed, der er i stand til at isolere tumorceller. Kredit:Univer -
 Verdens ældste insekt inspirerer en ny generation af aerogelerKredit:Newcastle University Et team af internationale videnskabsmænd har skabt en ny form for højeffektive, lavpris isolering baseret på vingerne på en guldsmede. Materialet, kendt som en aerogel
Verdens ældste insekt inspirerer en ny generation af aerogelerKredit:Newcastle University Et team af internationale videnskabsmænd har skabt en ny form for højeffektive, lavpris isolering baseret på vingerne på en guldsmede. Materialet, kendt som en aerogel -
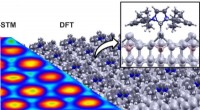 Ny metode til molekylær funktionalisering af overfladerSammenligning af den teoretisk beregnede struktur (DFT, til højre) af det bestilte NHC -enkeltlag med det eksperimentelle scanningstunnelmikroskopibillede (STM, venstre). N:nitrogenatom, C:carbonatom,
Ny metode til molekylær funktionalisering af overfladerSammenligning af den teoretisk beregnede struktur (DFT, til højre) af det bestilte NHC -enkeltlag med det eksperimentelle scanningstunnelmikroskopibillede (STM, venstre). N:nitrogenatom, C:carbonatom, -
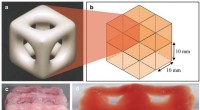 3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for
3-D-print skaber superbløde strukturer, der kopierer hjerne og lungerStruktur af en enkelt enhed; hvordan otte enheder passer sammen; to visninger af en trykt og fast struktur med otte enheder. Kredit:Imperial College London En ny 3D-printteknik gør det muligt for
- Hvorfor er det, at fordampning forårsager afkøling, men kogende opvarmning?
- Hvorfor folk ikke kalder falske COVID-19-vacciner på WhatsApp
- Hvor mange ounces svarer til 100 ml?
- Ny bog beskriver, hvordan hvalfangst formede amerikansk kultur, selv efter at olie erstattede den
- Tweets af væsentlige arbejdere viser overraskende positivitet under pandemi
- Hvad er en hastighedshastighed med tiden?


