Har CH4 en resonansstruktur?
* resonans opstår, når et molekyle kan repræsenteres af flere Lewis -strukturer, der kun adskiller sig i placeringen af elektroner, men ikke placering af atomer. Dette resulterer i, at den faktiske struktur er en hybrid af disse bidragydende strukturer.
* Methanes struktur: Metan har et centralt carbonatom bundet til fire hydrogenatomer. Alle bindinger er enkeltbindinger (C-H), og alle hydrogenatomer er lige fordelt omkring carbonatomet i en tetrahedral geometri.
* Ingen elektron -delokalisering: Der er ingen flere bindinger eller ensomme par på carbonatomet, der kan delokaliseres. Dette betyder, at der ikke er nogen mulighed for at omarrangere elektroner til at skabe forskellige Lewis -strukturer.
Derfor har metan en enkelt, stabil Lewis -struktur og udviser ikke resonans.
 Varme artikler
Varme artikler
-
 Optrævler hemmelighederne bag Tennessee whiskyStuderende ved UT Department of Food Science indsamler prøver af whiskydestillat til kemisk analyse hos Sugarlands Distilling Company i Gatlinburg, Tennessee. Kredit:J. Munafo, UTIA. Mere end et å
Optrævler hemmelighederne bag Tennessee whiskyStuderende ved UT Department of Food Science indsamler prøver af whiskydestillat til kemisk analyse hos Sugarlands Distilling Company i Gatlinburg, Tennessee. Kredit:J. Munafo, UTIA. Mere end et å -
 En ny løsning til spildevandsrensningKredit:Pixabay/CC0 Public Domain Syntetiske farvestoffer bruges på tværs af en lang række industrier og udgør en alvorlig bekymring, når det kommer til vandforurening. Disse farvestoffer er ikke ku
En ny løsning til spildevandsrensningKredit:Pixabay/CC0 Public Domain Syntetiske farvestoffer bruges på tværs af en lang række industrier og udgør en alvorlig bekymring, når det kommer til vandforurening. Disse farvestoffer er ikke ku -
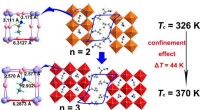 Forskere erhverver høj-Curie-temperatur lagdelt metalhalogenid ferroelektrik via bur-indesluttede e…Skematisk illustration af strategien. Kredit:Prof. LUO Junhuas gruppe Todimensionelle (2-D) organiske uorganiske hybridperovskit (OIHP) ferroelektriske stoffer har tiltrukket sig stor opmærksomhed
Forskere erhverver høj-Curie-temperatur lagdelt metalhalogenid ferroelektrik via bur-indesluttede e…Skematisk illustration af strategien. Kredit:Prof. LUO Junhuas gruppe Todimensionelle (2-D) organiske uorganiske hybridperovskit (OIHP) ferroelektriske stoffer har tiltrukket sig stor opmærksomhed -
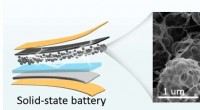 Hierarkisk porøse kulstofnetværk indlejret med enkelte jernsteder til effektiv iltreduktionBilledet til venstre viser den fleksible batterimodel. Et billede af neuronlignende selvbærende fleksibel porøs kulstofstruktur er vist til højre. Kredit:Science China Press I øjeblikket lider oxyg
Hierarkisk porøse kulstofnetværk indlejret med enkelte jernsteder til effektiv iltreduktionBilledet til venstre viser den fleksible batterimodel. Et billede af neuronlignende selvbærende fleksibel porøs kulstofstruktur er vist til højre. Kredit:Science China Press I øjeblikket lider oxyg
- Redoxdivergerende strategi til konstruktion af (dihydro)thiophener med dimethylsulfoxid
- Røde supergigantiske stjerner bobler og fråder så meget, at deres position på himlen ser ud til …
- Arbejder hen imod mindre støj og bedre brændstofeffektivitet under indflyvning til lufthavnsbanen
- Fysikere optrævler mysteriet med gentagne DNA-segmenter
- Hvad bliver der gjort for at holde fugleinfluenza ude af fødevareforsyningskæden?
- Hvad er vandtrykket i psi i en dybde på 300 fod?


