Hvem er resultater demonstreret, at elementer kombineres i specifikke proportioner, fordi de er lavet af individuelle atomer?
Daltons atomteori , baseret på hans observationer og eksperimenter, foreslog følgende:
* elementer er sammensat af små, udelelige partikler kaldet atomer.
* atomer af det samme element er identiske i masse og egenskaber.
* atomer af forskellige elementer har forskellige masser og egenskaber.
* Kemiske reaktioner involverer omarrangement af atomer, ikke deres skabelse eller ødelæggelse.
Daltons lov om flere proportioner yderligere størknet dette koncept. Denne lov siger, at når to elementer danner mere end en forbindelse, er masserne af det ene element, der kombineres med en fast masse af det andet element, i forhold mellem små hele tal. For eksempel kan carbon og ilt danne to forbindelser:kulilte (CO) og kuldioxid (CO₂). Forholdet mellem iltatomer i CO til CO₂ er 1:2, der er i overensstemmelse med Daltons teori om atomer, der kombinerer i specifikke proportioner.
Andre centrale bidragydere til udviklingen af atomteori inkluderer:
* Joseph Proust: Hans lov om bestemte proportioner oplyste, at en given kemisk forbindelse altid indeholder de samme elementer i den samme andel af masse.
* Antoine Lavoisier: Hans arbejde med bevarelse af masse hjalp med at lægge grundlaget for Daltons atomteori.
Mens Daltons atomteori er blevet modificeret over tid med opdagelsen af subatomære partikler og isotoper, er det stadig en grundlæggende hjørnesten i moderne kemi, hvilket giver en ramme for forståelse af stoffet og kemiske reaktioner.
 Varme artikler
Varme artikler
-
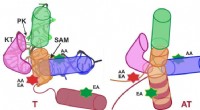 Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære
Hvordan molekylære riboswitches virker i bakterierSkematisk repræsentation af SAM-I riboswitchen i terminatorkonformationen (sluk; venstre) og antiterminatorkonformationen (switch til; højre). Kredit:Grafik:APH/KIT Mange bakterier har molekylære -
 Forskere kan spore farlige kemikalier fra fastfood-indpakninger i kroppenDette er et kig inde i UABs Cyclotron, som fremstiller radioaktive molekylære billeddannelsesmidler til nuklearmedicin ved hjælp af en type partikelaccelerator, der flytter protoner, en slags ladet pa
Forskere kan spore farlige kemikalier fra fastfood-indpakninger i kroppenDette er et kig inde i UABs Cyclotron, som fremstiller radioaktive molekylære billeddannelsesmidler til nuklearmedicin ved hjælp af en type partikelaccelerator, der flytter protoner, en slags ladet pa -
 Ny forskning afslører hemmelighederne bag fotosyntesen, der kan hjælpe med at udvikle computertekn…Illustrerer, hvordan destinationen for en elektron (repræsenteret af toget) kan dirigeres efter påføring af en ultrahurtig mid-infrarød puls (repræsenteret af ilden). Kredit:Helen Towrie ved CLF F
Ny forskning afslører hemmelighederne bag fotosyntesen, der kan hjælpe med at udvikle computertekn…Illustrerer, hvordan destinationen for en elektron (repræsenteret af toget) kan dirigeres efter påføring af en ultrahurtig mid-infrarød puls (repræsenteret af ilden). Kredit:Helen Towrie ved CLF F -
 Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
Zink regulerer lagring og frigivelse af neurotransmittereZink er et vigtigt mikronæringsstof involveret i mange cellulære processer:F.eks. i lærings- og hukommelsesprocesser, det spiller en rolle, som endnu ikke er forstået. Ved at bruge nanoelektrokemiske
- Hvad betyder ikke -reproduktive celler?
- Hvilke 3 ting kan der ske, når lys rammer et materiale?
- Hvordan videnskab påvirker værdier, og hvordan samfundet påvirker videnskaben?
- Hvis bariumioner Ca2 har en ladning på 2 og hydroxid CL1 1- Det forbundne calciumchlorid er?
- Hvilken effekt, når for meget minedrift og stenbrud med det formål at få ædle metaller sten grus…
- Hvad er det vigtigste middel til forvitring og erosion på jorden?


