Hvorfor producerer placering af to forskellige metaller i en frugt en elektrisk strøm?
1. Elektrokemiske reaktioner: Frugtens sure juice fungerer som en elektrolyt, der giver ioner mulighed for at bevæge sig. Når de forskellige metaller (som kobber og zink) anbringes i saften, forekommer en kemisk reaktion på overfladen af hvert metal.
* Oxidation: Et metal (typisk den mere reaktive, som zink) mister elektroner og bliver positivt ladet (oxideret).
* reduktion: Det andet metal (som kobber) får elektroner og bliver negativt ladet (reduceret).
2. Elektronstrøm: Forskellen med hensyn til de to metaller skaber en potentiel forskel, hvilket kører elektroner til at strømme fra det negativt ladede metal til det positivt ladede metal. Denne strøm af elektroner er det, vi opfatter som en elektrisk strøm.
3. frugt som elektrolyt: Frugtens sure juice giver de nødvendige ioner til at lette strømmen af elektroner. Sålens surhed er afgørende; Jo mere surt det er, jo stærkere strømmen er.
Det handler ikke kun om metaller:
* frugternes surhed: Jo mere sur frugten er, jo stærkere strømmen er.
* Typen af metaller: Forskellige metaller har varierende reaktivitet. Kobber og zink bruges ofte, fordi de har en signifikant forskel i reaktivitet, hvilket resulterer i en stærkere strøm.
* overfladeareal på metaller: Større overfladearealer i kontakt med elektrolytten giver mulighed for flere reaktioner, hvilket potentielt fører til en stærkere strøm.
Vigtig note: Strømmen produceret af et frugtbatteri er ekstremt svagt og kan kun drive meget små enheder. Det er mere en demonstration af elektrokemiske principper end en praktisk strømkilde.
 Varme artikler
Varme artikler
-
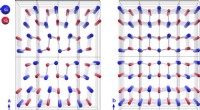 Højeffektive termoelektriske materialer:Ny indsigt i tinselenidSnSe er en meget lagdelt ortorhombisk struktur. SnSe gennemgår en faseovergang af anden orden ved 500°C med en forøgelse af krystalsymmetrien fra rumgruppen Pnma (venstre) til Cmcm (højre). Kredit:HZB
Højeffektive termoelektriske materialer:Ny indsigt i tinselenidSnSe er en meget lagdelt ortorhombisk struktur. SnSe gennemgår en faseovergang af anden orden ved 500°C med en forøgelse af krystalsymmetrien fra rumgruppen Pnma (venstre) til Cmcm (højre). Kredit:HZB -
 Sensoren kan registrere fordærvet mælk, før den åbnesDen eksperimentelle opsætning til påvisning af de flygtige forbindelser i mælk, med de lyserøde nanopartikler set over væsken. Kredit:WSU Udløbsdatoer på mælk kan i sidste ende blive fortid med ny
Sensoren kan registrere fordærvet mælk, før den åbnesDen eksperimentelle opsætning til påvisning af de flygtige forbindelser i mælk, med de lyserøde nanopartikler set over væsken. Kredit:WSU Udløbsdatoer på mælk kan i sidste ende blive fortid med ny -
 Stærke og duktile Damaskus-stål ved additiv fremstillingFig. 1:Optisk mikrofotografi, der viser en lagdelt Damaskus-lignende struktur bestående af en sekvens af bløde og hårde bånd. De hårde bånd ser mørke ud i det optiske mikrofotografi, fordi de Ti-rige
Stærke og duktile Damaskus-stål ved additiv fremstillingFig. 1:Optisk mikrofotografi, der viser en lagdelt Damaskus-lignende struktur bestående af en sekvens af bløde og hårde bånd. De hårde bånd ser mørke ud i det optiske mikrofotografi, fordi de Ti-rige -
 Reducerer kraftværkernes ferskvandsforbrug med nyt silicafilterSandia National Laboratories forskere, venstre til højre, Tina Nenoff og Pat Brady og tidligere postdoktorudnævnte Koroush Sasan undersøgte, hvordan hydrotalcit kan filtrere silica ud af køletårnets v
Reducerer kraftværkernes ferskvandsforbrug med nyt silicafilterSandia National Laboratories forskere, venstre til højre, Tina Nenoff og Pat Brady og tidligere postdoktorudnævnte Koroush Sasan undersøgte, hvordan hydrotalcit kan filtrere silica ud af køletårnets v
- En liste over tre egenskaber af ioniske forbindelser
- Rejser gaspartikler i en lige linje, indtil de kolliderer med et objekt?
- Hvordan vi måler virkningerne af metan har betydning for klimapolitikken
- Hvor mange stjerner er der i kraterkonstellationen?
- Hvad holder DNA i kernen, som er omsluttet af sin egen membran?
- Hvad er en generel erklæring, der vedrører størrelserne af partikler stoffer og deres kombinerede…


