Hvad er den kemiske kilde til elektricitet?
Her er en oversigt over, hvordan dette fungerer:
1. Kemiske reaktioner:
* Kemiske reaktioner involverer brud og dannelse af kemiske bindinger. Dette kan involvere overførsel af elektroner mellem atomer eller molekyler.
* Elektrokemiske reaktioner involverer specifikt overførsel af elektroner mellem forskellige kemiske arter (atomer eller molekyler).
* Disse reaktioner kan frigive eller forbruge energi, som kan udnyttes som elektricitet.
2. Elektrisk potentiale:
* Når en kemisk reaktion forårsager adskillelse af ladninger (elektroner og positivt ladede ioner), skabes en forskel i elektrisk potentiale.
* Denne potentielle forskel er som en trykforskel, der skubber elektroner til at bevæge sig fra et område med højere potentiale til et område med lavere potentiale.
3. Strøm af elektroner:
* Elektroner flyder gennem et ledende materiale, som en ledning, fra den højere potentielle region til den lavere potentielle region.
* Denne strøm af elektroner udgør en elektrisk strøm .
Eksempler på kemiske kilder til elektricitet:
* Batterier: Brug elektrokemiske reaktioner til at generere elektricitet.
* brændselsceller: Brug elektrokemiske reaktioner til at omdanne kemisk energi fra et brændstof som brint til elektricitet.
* elektrolyse: Bruger elektricitet til at drive ikke-spontane kemiske reaktioner, som at opdele vand i brint og ilt.
Kortfattet:
Den kemiske kilde til elektricitet kommer fra frigivelse eller forbrug af energi under kemiske reaktioner, især elektrokemiske reaktioner, der skaber en forskel i elektrisk potentiale, der driver bevægelsen af ladede partikler (elektroner) gennem et ledende materiale.
Sidste artikelHvad hopper luftmolekyler af?
Næste artikelHvad videnskabsmand opdagede, at atomer har en positiv ladning?
 Varme artikler
Varme artikler
-
 Præcise magneter 3-D printet af specielt rustfrit stålEmpa præcist magnetiseret:Jernspåner klæber til dette mini skakbræt med fire millimeter kantlængde. Den delvist magnetiske struktur blev fremstillet af en enkelt type stålkraft ved forskellige tempera
Præcise magneter 3-D printet af specielt rustfrit stålEmpa præcist magnetiseret:Jernspåner klæber til dette mini skakbræt med fire millimeter kantlængde. Den delvist magnetiske struktur blev fremstillet af en enkelt type stålkraft ved forskellige tempera -
 Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing
Scanner tusindvis af molekyler mod et uhåndgribeligt kræftmålEn ny undersøgelse udviklede et sæt metoder til at screene tusinder af små molekyler for at finde hæmmere af kræftmålet NSD2. Kredit:Matthew Hall, NCATS Forskere ved National Center for Advancing -
 Innovativ model skabt til NASA til at forudsige vitaminniveauer i rumflyvningsmadUMass Amherst professor i fødevarevidenskab. Kredit:UMass Amherst Et hold af fødevareforskere ved University of Massachusetts Amherst har udviklet en banebrydende, brugervenlig matematisk model fo
Innovativ model skabt til NASA til at forudsige vitaminniveauer i rumflyvningsmadUMass Amherst professor i fødevarevidenskab. Kredit:UMass Amherst Et hold af fødevareforskere ved University of Massachusetts Amherst har udviklet en banebrydende, brugervenlig matematisk model fo -
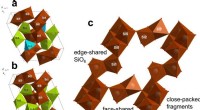 Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te
Silica paradoks:Forskere opdager tilsyneladende umuligt materialeHavet), (b) er rumlige krystalgitter af coesit, (c) viser uindpakket gitter med tydeligt synlige fragmenter af SiO6, paradoksalt nok forbundet af ansigterne. Kredit:NUST MISIS Et internationalt te
- Hvad er atomprocessen, der forekommer i kernen i stjerner?
- Hvilket organ i vores solsystem har en magnetpolevejsninger?
- Hvad er et mikroskop inden for videnskab?
- Landformer af græslandets biom
- Forskelle fundet i antioxidantaktiviteter af astaxanthinisomerer mod singlet oxygen
- Hvorfor uafhængige kulturer tænker ens, når det kommer til kategorier:Det er ikke i hjernen


